All aktivitet
-
Reefmeet, Norge, 24 mars 2019
Välkomna alla svenska akvarister till den mkt trevliga dag. Ort annonseras senare, men förra året var det i den charmiga staden Dröback, och undertecknad tröttade ut auditoriet med kemi;_) Trots det har jag fått förtroendet att föreläsa igen, men denna gång blir det mer praktiskt där jag pratar om mitt akvarium, mkt bilder, och utifrån det gör lite biologiska utflykter, samt pratar om min spännande resa från ide till produkt. Kul om så många svenskar som möjligt kommer, särskilt då vi pgr av sjöfartsmuseets ombyggnad inte kommer ha en egen träff där i år. /Jonas Roman
-
För bra för att vara sant?
Randy har skrivit och bidragit till mkt, men de senaste åren är det mkt copy past, och väldig mkt av hans svar idag är hänvisningar till hans tidigare (helt excellenta) pedagogiska gärning. Jag har lärt mig massor av Randy, ibland har Lasse retat mig för att jag sett honom som en husgud, och ja, det kanske jag gjorde på den tiden. Men vi är i en ny tid nu, Randy är inte aktiv på det sättet längre, och det är väl inte konstigt, för kemin ändrar sig ju inte. Vi och jag tackar Randy för väldig mkt, men det finns andra idag som har en mer modern syn på det hela. Skall jag vara rättvist kritisk så är Randys "minus" att han blir onödigt teoretiskt (skall jag säga...haha...jag har självinsikt, tro mig), samt tappar kontakten med hobbyn. Vi har haft en del diskussioner där jag inte längre ser hans svar som sanningen, och faktiskt tycker han klamrar sig fast lite vid för mkt gammalt. Så nej Lasse, han är inte min husgud. Husgudar har man när man är i början av sin karriär, sen inser man att dom finns inte, samt att andra betraktar oss som sådana (fast även det kommer ju falna av samma skäl).... Skulle jag nämna ett namn...Julian Sprung...han är biolog, akvarist, kemist, samt utomordentligt ödmjuk. Träffade honom på interzoo. Sen finns två gurus till, som betytt massor, o betyder massor, och det är våra hedersmedlemmar, @stigigemla och @Lasse, som bisitter med enorm kunskap och erfarenhet. Och eran storhet, förutom erat stora teoretiska kunnande, är ju eran fasta förankring i akvaristiken, med ibland ett mer bildligt sätt att förklara saker (läs bra), än tex mina egna o Randys formler;-)...så tack för vad ni gör:-) Ursäkta sidospåret, ville bara säga det:-) Happy reefing....det uttryckt gillar jag dock;-) Jonas
-
För bra för att vara sant?
Ja, de är sant, Triton var nog först med ett kommersiellt Na2CO3-baserat recept(tror jag, men ej helt säker), men jag tror det funnits ganska länge innan egengjorda sådana i USA, där Randy skrivit o delat ut. Men vi i sverige o kanske europa, mest pgr av Hans Werner Balling(??), har naglat oss fast vid klassisk Balling med NaHCO3 längre än USA. Ganska intressant, för visst finns det fördelar med Na2CO3 baserade, och/eller i alla fall när en viss komponent består av det. Vet att det finns lite gamla recept från marinakvariet, samt du själv har ju också pratat om det länge, hur man kan göra en mix, typ 30/70 om man tex har lågt pH som issue, etc. Bra att det idag är mer belyst och man kan välja det som passar ens egen filosofi och framför allt situationen i karet:-) /Jonas
-
För bra för att vara sant?
Du var inte tydlig Lasse med som var det romanska, men då förstår jag dig. Men då skulle jag vilja förtydliga lite;_): Jag doserar på natten också, men prioriterar så at säga ett stabilt KH framför ett stabilt pH. Det där handlar om vad man tror är bäst, det vet vare sig du eller jag, men i min värld så är det viktigare med stabilt KH än pH varvid jag sänker KH dosen på natten. Naturen gör ju likadant, där har du inga KH variationer över dygnet(inga stora i alla fall), men likväl pH variationer. Skulle va intressant att mäta KH i ditt kar över dygnet, är rätt säker på att det varierar ordentligt med kanske 0.5dKH högre på natten i o med din doseringsregim med icke reducerad dos på natten. Tror alltså att en korall stressas mer av en sådan KH fluktuation än en ph fluktuation, där ju den senare är den helt van vid från naturen (om än kanske inte i samma grad som i ett kar.) Har du lust att vara testpilot o se hur ditt KH varierar över 2 dygn med din regim?, inte för att du skall ändra nåt sen, utan får o veta. Du vet ju bara hur ditt pH svarar på detta du kallar "oromanska" sätt, men du vet inget om hur KH varierar. Är du inte nyfiken på det? Är det inte alls viktigt tror du?? Mvh Jonas
-
Alkatronic Controller
Info: Alkatronic batch 3 finns i lager hos Dejong (samt alla andra distributörer i världen också) inom 1-2v:-). Vi skeppar ut nästa vecka från Hong Kong:-) Batch 3 har följande Highlights: 1) Ännu tystare, samt nu även full dämpning(med bussning) av pump C. 2) Ett safety drain hole, som säkerhet, ifall man klantar sig o glömmer sätta tillbaka ett rör eller vad som helst. Den mänskliga faktorn ni vet. 3) Ännu bättre kalibreringscylindrar, för att ännu lättare nå vår accuracy som är på 0.05dKH utan att behöva använda baseline cal. 4) Snyggare försänkning av pump B o D. /Jonas Roman, Designer av Alkatronic
-
För bra för att vara sant?
@Lasse, vadå "oRomanska sätt"? Jag gör likadant sen länge. Har du inte läst mitt recept? Mitt recept innehåller också (och enbart) Na2CO3, så vad är det "oromanska" i att använda ett romanskt recept???? Det jag skriver ovan har dock inget med detta att göra, det jag skriver, och det står jag fast vid, är att om du använder NaOH istället för en karbonatinnehållande KH höjare, så kommer du få en förskjutning i viss mån(hur mkt och om det spelar roll kan diskuteras) av vad som bygger upp din alkalinitet, TROTS att OH jonerna innebär att en del CO2 dras ner. Du kommer ligga med ett konstant högre pH (som du också tycks hålla med om) på grund av att inte alla av de tillförda OH jonerna kommer förenas med CO2, i sin tur beroende på att CO2 ej hinner helt ställa in sig i den nya jämnvikt som OH jonstillsatsen vill strävar efter. Dvs, i o med att inte alla OH joner kommer förenas med CO2, blir summan av detta att om du tillför X mol NaOH, så kommer det inte leda till en ökning av sann karbonatalkalinitet med X mol, utan med X-Y Mol, där Y består av annan alkalinitet. Du kommer INTE märka detta med ett "KH" test eftersom den bara och alltid mäter total alkalinitet o ger dig ingen info om vilka joner som alkaliniteten byggs upp av. Sen hur mkt detta spelar roll, det har jag inte uttalat mig om, men de facto är att man får en viss förskjutning rörande vilka joner som bygger upp alkaliniteten, till nackdel för sann karbonatalkalinitet, och detta var också vad tråden handlade om. Ju bättre luftning man har av karet (läs mer CO2 lyckas dras ner till följd av OH tillsättningen), desto mer av de tillförda OH jonerna omvandlas till sann karbonatalkalinitet. Så ju mer effektiv luftning man har, desto mindre spelar det såklart roll att köra med NaOH istället för karbonater. Men varför överhuvudtaget "chansa" och använda en KH tillsättningsmetod som är beroende av viss fart på utluftningen? Såklart sämre, än att göra som vi i princip alla redan gör. Därför tycker jag, som jag inledde tråden med, att det inte är helt perfekt att höja en alkalinitet med NaOH, om man är ute efter att total alkalinitet skall byggas upp till 95% av sann karbonatalkalinitet (och det vill man). Mitt recept innehåller precis som core 7, ren Na2CO3. Det leder till ett konstant lite högre pH precis som om vi hade använt NaOH, MEN denna kemikalie kräver inte att vi har fullständig jämnvikt med luftens CO2 för att den tillförda alkaliniteten skall vara lika med sann karbonatalkalinitet. Att vi använder Na2CO3 framför NaHCO3 har ju 2 syften. 1) Dels vill man ibland ha just denna ph höjning i de fall (läs de flesta) det är svårt att vädra ut CO2 överskott, dvs man går med ett kroniskt för lågt pH 2) Man kan få en upp till nästan 5 ggr så stark KH lösning, vilket är praktiskt om man inte vill blanda stup i ett. Om jag minns dig rätt Lasse, och det är jag rätt säker på att jag gör, så kritiserade du metoden att använda ren Na2CO3 som KH höjare för att du menade att det var farligt pgr av dess ph höjande effekt. Det är det inte(vid normal dosering såklart). Men nu vänder du o skriver att du använt denna kemikalie länge (core 7), och dessutom påstår att det är en icke romansk metod, fast det är precis tvärtom, det är det ju det jag kör med också i mitt recept. Na2CO3 används förresten i fler o fler recept(red sea liquid, ati essential pro, Triton core 7, Roman mezzoforte, Randys egna, etc) , och i USA har man gjort det länge sedan standard i deras 2 part system. /Jonas
-
För bra för att vara sant?
Bara det faktum att pH värdet ligger konstant högre om man tillsätter OH, bevisar att det INTE uppstår just denna totala jämnvikt. Dvs, det kommer bli kvar en del OH joner som ej drar ner motsvarande mängd CO2. För om det hade uppstått total jämnvikt hade pH värdet ej blivit konstant högre. Det är samma med Na2CO3, där får vi också på grund av att total jämnvikt aldrig hinner helt ställa in sig, ett konstant lite högre pH. MEN, där har vi i alla fall tillfört alkaliniteten som sann karbonatalkaliniteten.
-
För bra för att vara sant?
Korrekt, håller med, men den senare varianten med OH, kräver att du får total jämnvikt...annars innebär ju det inte att alla OH joner leder till motsvarande karbonatalkalinitet. Och vi vet ju att det aldrig uppstår total jämnvikt. I ett experiment, med tillräcklig väntan, då blir det som du säger, men ett akvarium kommer aldrig i total jämnvikt.
-
För bra för att vara sant?
där ser man, isåfall håller jag inte med honom. NaOH ger indirekt en sann ökad karbonatalkalinitet med tiden, JA, men som sagt indirekt, för det krävs ett motsvarande upptag av CO2 från luften. Det är ju inte säkert att det sker i samma omfattning eftersom man inte har total jämnvikt mellan vatten/luft nånsin i princip. Därför tror jag att en del NaOH ej kommer leda till sann ökad karbonatalkalinitet. Och varför gå omvägen? Jag står därför fast vid att man med NaOH introducerar en risk att få en skevhet i vilka joner som bygger alkalinteten. Vad tror du själv Lasse?:-) /Jonas
-
Romans balling
Ja, tack:-) Jätteviktig med ljuset. Videon ovan visar på det:-) Jag kör som sagt Kessils landväxtvariant, otroligt bra lampa, men ganska dyr.
-
PDF om kalcium, magnesium och KH
Jag tror Stig skrev nästan samma, men skadar ju inte att få det från fler håll. Men ngr saker från mig 1) Stabilitet är A o O o är viktigare än värdet i sig 2) Ej över 10 skulle jag säga. Jag tycker red seas tillväxtprogram är lite "risky". Risk för brända toppar med för högt KH, samt kanske kanske enligt min teori, större risk för dino (ej bevisat, min egna teori) 3) Ett plötslig stegring av KH under kort tid, tex pgr av ett vattenbyte är ofarligt. Det är de plötsliga fallen nedåt som är farligt!. 4) Härma naturen även här, dvs så länge KH är över 7 så är det bra 5) Men ett KH runt 8--9 kommer tydligt öka tillväxten på korallerna, så det kan va ett bra sätt att få fart på dom samt faktiskt också få lite mer färg på korallerna, då det oftast är mer färg i tilläxtzooner. 6) Salifert KH test. Läs av vid lila, allra första färgomslaget 7) AF KH test, tvärtom, las av vid rött, dvs 2 droppar in i färgomslaget 8) ALLA manuella dropptester i princip mäter 0.2-0.3dKH för högt, (när testet är helt nytt o du gör allt rätt), pgr att deras ändtitreringspunkt ligger lite för lågt (runt pH 3.9). 9) Skillnaden mellan olika manuella tester kan va upp till 30%(läs test i AA) 10) Men, återigen, stabilitet är viktigare än det egentliga värdet. /Jonas
-
Colans SPS dominanta rev
Vad fint o spännande projekt. skall följa! Funkar allt bra med Alkatronicen? Jag har drunknat i vem som har vilken maskin nu;_) (är ju positivt), så ursäkta om jag ej minns detaljerna. Du har väl uppgraderat;-) Bara o höra av dig om behöver hjälp:-) Happy reefing Jonas
-
Romans balling
Jag är glad att ni gillar mitt recept. Det är kört ganska länge nu av flera akvarister o funkar bra. Det är lite svårare att få tag på Na2CO3 men fraktfritt.se har Spårelemeten jag hänvisar till är fauna marines mest för att det är enkelt. (o testat). Jag gjorde flera ICP tester under perioden när jag provade min mezzoforte och fick fina ICP värden, så det är i alla fall ingen överdosering av ngr spårelement. Järn kan va i underkant om man har stort refugium, och Kalium likaså, men det gäller alla Balling. Ingen Balling tillsätter kalium i nån betydande mängd(inte heller core 7 refugium method) utan det skall man alltid göra separat. 2 situationer som drar mkt kalium är 1) stort algrefugium med bra (rätt) ljus 2)zeolitsten Jag blandar min kaliumklorid själv, och doserar utifrån manuell mätning med salifert utmärkta kaliumtest. När jag rensat alger i refugiet drar det märkbart mer med cirka 20 ppm första veckan, sen stannar det upp. /J
-
Romans balling
Fast med ett undantag(men du skrev ungefär så du har rätt): Triton kör xx7 på Mg o Ca och xx3.5 på KH, det gör att man ej kan dosera olika utan måste dubbla KH dosen med core 7 ELLER köra med 4 pumpar. Med mitt recept går det med 3 pumpar o lika dosering från alla. Enklare tycker jag, så kan man ställa in dosering samma på alla. MEN, såklart ingen viktig skillnad. Den största fördelen med Triton är väl att den är färdigblandad så man slipper jobbet, men så är de ju med alla andra med. ATI essentials PRO är 5 ggr starkare så dom ligger mellan "min" o tritons, också rätt smart för då blir det lika dosering från alla där med. Jag har medvetet lagt mig på ggr 3.5 för att det då också blir lite större volymer att dosera=högre noggrannhet. /Jonas
-
lanthanum klorid kan sänka Alkaliniteten
Många ämnen vi tillsätter kan påverka alkaliniteten. Mer än vi tror eller vet om vi inte är där o mäter stup i ett... Så en lista på ngr, som jag själv "upptäckt" men också stämmer med litteraturen 1) Lathaniumklorid. Binder ej bara fosfat utan också CO3, så det bildas lathaniumkarbonat, dvs alkalinitet konsumeras. Ganska tydlig effekt! 2) GFO. Min personliga tero är att GFO innehåller också järnklorid, som i sin tur mkt potent binder hydroxidjoner, o därmed rätt snabbt sänker alkaliniteten. (och pH). 3) Coral snow. Innehåller CaCO3 kristaller som kan fungera som likt en snöboll man rullar, en precursor för att bilda större kristaller. /Jonas Roman De var punkt 1 som var det nya
-
Dosera KH2PO4
Låter som du är försiktigt o klok, o då kan det ju gå bra:-)
-
Dosera KH2PO4
Jo det tror jag för det är ju organiskt bunden:-)
-
Dosera KH2PO4
Vill varna för fosfatdosering: 1) Fönstret för vad som är ok gällande fosfat är mkt litet 2) Halterna är dessutom låga, så det är lätt att åka utanför fönstret pgr av: mätfel, räknefel,doserfel 3) Konsekvenserna av snabbt för högt fosfat är ganska ödesdigra (bruna koraller på ett par dar, en del kan dö, utebliven kalkbildning o tillväxt) 4) Risken för helt 0 i fosfat om du matar, samt ej kör med kemisk remover eller ej kör stenhårt med kolkälla ihop med nitrat, är mkt liten. 5) Lågt fosfat men ändå över noll, är inte skadligt. Snarare tvärtom. Det är ultralågt nitrat som är värre, det ger bleka tråkiga koraller o cyano ibland. Jag skulle matat mer, o kanske lite korallmat, både zoo o phytoplankton. Undvik aminosyror. Det bildar korallerna själva om dom bara får sina grundstenar. Sen är det ju aldrig fel med ett ICP test då o då, det kanske inte alls är N o P som är orsaken till att din anenom ej trivs. /Jonas
-
Mikroorganismer saknas
Du kan ju ha en förgiftning pgr av ngt av de skäl Stig nämner, saltet tex skulle jag inte litat på i första taget. Skicka in ett ICP test så vi ser att du inte har ngt uppenbart fel, som tex för högt koppar. /Jonas
-
För bra för att vara sant?
tackar:)...din magkänsla är med säkerhet väldigt vältränad baserat på all din erfarenhet, så bra att du tog upp frågan:-)
-
För bra för att vara sant?
Dessutom så är KH delen INTE karbonater, utan hydroxidjoner, så det blir på sikt en felaktig kvot vad som bygger upp alkaliniteten. OH joner höjer alkaliniteten, ja, men inte karbonathårdheten direkt. På sikt kommer vi få ett vatten med lågt KH men trots det normal alkalinitet. I ett NSW så byggs alkaliniteten upp till 95% av KH(karbonatalkalinitet), men om alkaliniteten på sikt byggs mer o mer upp av hydroxidjoner, kommer vi få ett skifte, där den totala alkaliniteten proportionellt sett byggs upp mindre av rena karbonater och mer av andra joner såsom silikater, fosfater, borater, samt rena hydroxidjoner. Det vill vi inte. Varför finns detta preparat ens? Vi har ju ett fantastiskt och framför allt RÄTT sätt att tillföra Ca/Kh/Mg på. Vi vet skälet...business. /Jonas
-
För bra för att vara sant?
Öppnade länken, det var som jag gissade, det är bundet till organiska molekyler, närmare bestämt acetat. Så kolkälla kommer med på köpet...vill vi att dosen kolkälla skall vara proportionell mot Ca/KH förbrukningen? Nej det vill vi ju inte;-)... Diss från min sida Jonas
-
För bra för att vara sant?
länken går ej öppna för mig...men så här kan jag säga direkt: Om flaskan innehåller oorganiska Ballingsalter så är det helt omöjligt med ett sådant preparat. Tropic marine har exakt detta men i torr pulverform. Detta pulver kan ej lösas upp i vatten innan, då fäller det ut karbonatsalter. Det pulvret skall hällas direkt ner i karet, då hinner det ej kristalliseras. En variant skulle va om det är organiskt bundet, men vem vill ha det i den formen? Då får man med annan "skit" på köpet. Organiska ämnen vill du dosera kontrollerat. Men det är isåfall den enda förklaringen jag kan komma på, att det är bundet till organiska molekyler. Sen om det nu är det, hur vet vi då att det sen i karet frisätts så det kan nyttjas? Om det är bundet till en organisk molekyl kan det ju för det första skummas ut, vilket man ju inte vill, alternativt ej tas upp av korallen. Skall se om jag har nån mer kommentar om jag lyckas öppna filen. /Jonas
-
Nybörjar kemi.
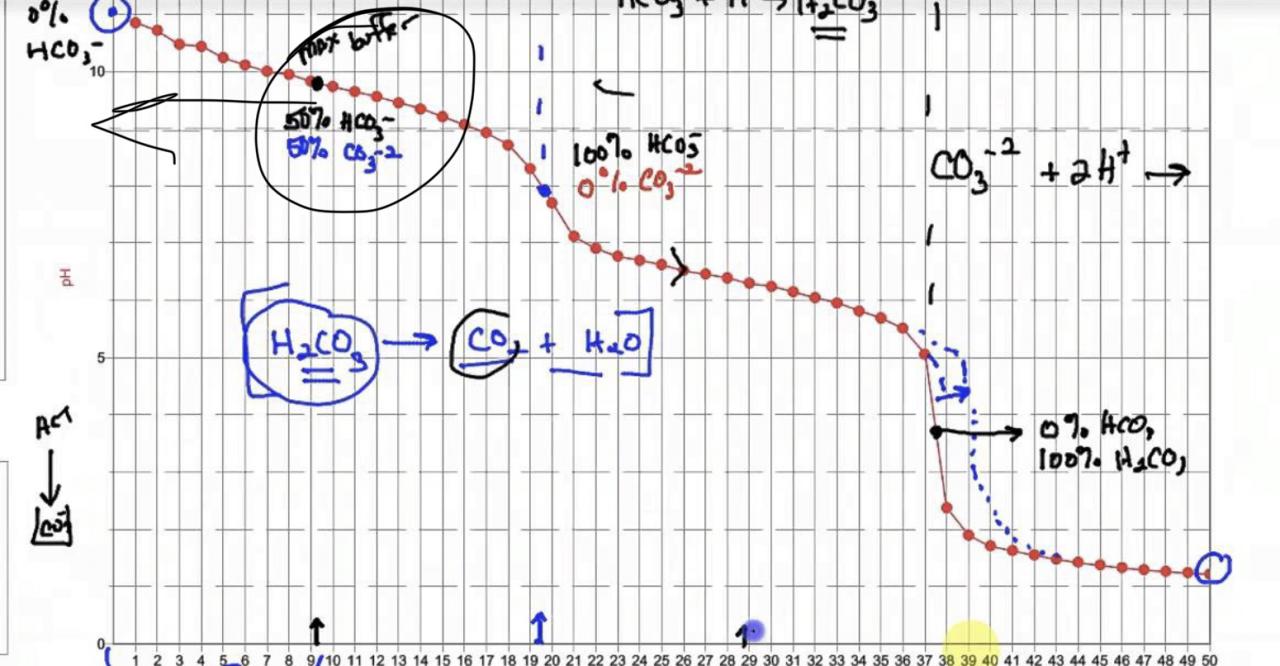
Därför att som sagt pKa värdena är olika i söt o saltvatten(och dessutom stor skillnad, se nedan). Lite schematiskt kan man kanske "förklara" det med CO2..om du har ett sötvatten med CO2 halten X, o ett saltvatten (ren NaCl) med samma CO2 halt, kommer saltvattnet få ett lägre pH än sötvattnet. Det beror på också där att pka värdena är olika i sött o salt. Man kan säga att dissociationskonstanten är olika. Jonstyrkan gör att koldioxid drar mer åt höger i saltvatten vid i övrigt samma förhållanden, dvs jämnviktskonstanten(ja pka alltså) är helt enkelt inte samma vid salt o sötvatten. Dessutom skiljer den en hel del. I saltvatten som sagt är pKA för CO3 8.9, men i sötvatten 10.3. Samma gäller neråt. Därför tex går det egentligen inte att mäta alkalinitet korrekt med ett saliferttest som är gjort för saltvatten, då ändtitreringspunkten för HCO3 är högre (runt pH 5-5.5 tror jag) för sötvatten. Se bilden jag postade. Så det är helt logiskt att så länge du har HCO3 joner kvar i vattnet så buffrar dom o låser fast vattnets pH (hyffsat bra) kring pKa värdet 8.9. Såklart lyckas dom inte helt, så ditt pH på 9.3 är fortfarande på den flacka linjen där bufferten är stark. Men om du fortsätter tillföra en bas, och som i detta fall krävs det också med en vissa hastighet, så kommer HCO3 ta slut till slut, och pH sticker upp till pH 11-12. Men dit kommer du aldrig, oavsett med vad du höjer pH så länge du har buffert kvar. Därför menar jag, som jag inledde denna tråd med, att ditt scenario har ingenting att göra med mixen på den substansen då råkade överdosera. Det du ser är HCO3 jonens buffertarbete (o dessutom i ett saltvatten). Och för att knyta tillbaka till just den frågan är jag nästan 100% på att det är ren Na2CO3 i core 7, eftersom pH i denna lösning som sagt är 12. Förvisso tycker jag inte det spelar nån roll om den skulle innehålla lite NaHCO3 (men varför skulle den?). När du ser i tabeller är det nästan alltid pka för sötvatten man finner, men googlar du, hittar du värden för salt med. Sen varför det på molekylnivå är så att pka är olika för söt o saltvatten, det är invecklat och är ju helt utanför detta kapitel, och det kan i alla fall inte jag förklara. Det räcker gott att bara acceptera. Mvh Jonas
-
Nybörjar kemi.
Olika pka för salt o sött dvs olika stoppnivåer. För söt ligger ju pka högre så där blir pH stoppet , max buffringen, vid ett högre värde. Runt 10.3. (Alltså pka för CO3 vid sötvatten) Se bilden. Ditt vatten motverkar bastillsättningen superbra så länge du har HCO3 joner kvar. Så vattnet låser sig runt 9.3-9.6. Sen till slut när du tillsatt tillräckligt med Na2CO3 så alla HCO3 är förbrukade då sticker det upp till 11-12. Mkn ring visar var du borde ligga i det scenario som hände dig. O där ligger du ett bra tag, beroende på din alkalinitet innan detta skedde. Som en kH titrering fast åt andra hållet. Därför får ju ett vatten helt utan buffert, som tex rent RO, ett pH på 12 direkt vid minsta tillsättning av Na2CO3. Men alltså inte ett buffrat vatten som ditt akvarium. Men när det sen lämnar pH 9.3 before ju på som sagt vad du hade i kH (o andra buffertar med) innan du började tillsätta din bas. Och också hur snabbt du tillsätter den eftersom den i sig också innehåller en buffert med den får tid på sig stt gå tillbaka som HCO3 joner. Som ju också skedde till slut dan därpå.