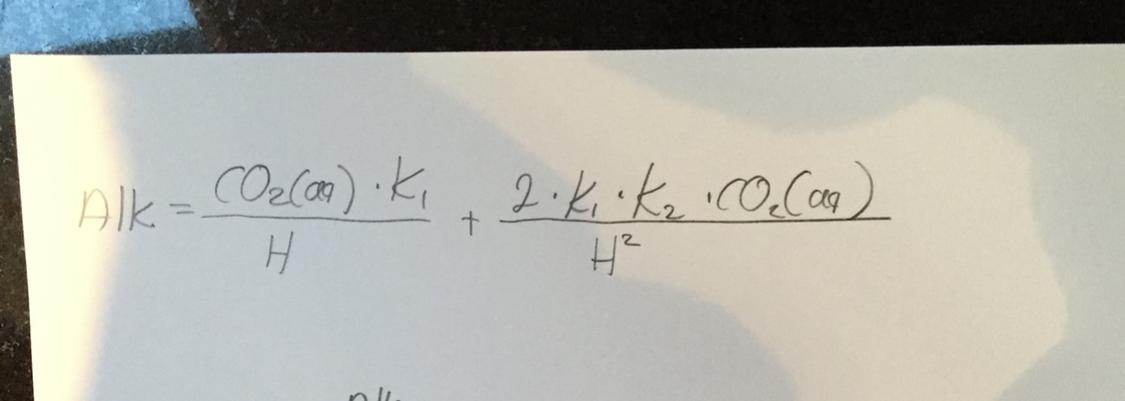All aktivitet
-
Magnesiumkloridhexahydrat & kalciumkloriddihydrat?
Calciumchloriddihydrat o Mg cl hexa finns i de flesta akvariebutiker som säljer salt. Na2CO3, natriumkarbonat, kan du köpa på fraktfritt.se NaSO4 kan du skippa tv om du kollar S då o då med ett ICP /Jonas
-
Kort presentation av Mastertronic
tack:-) 33(L) x 22.5 (w) x 34.5 (H) cm /Jonas
-
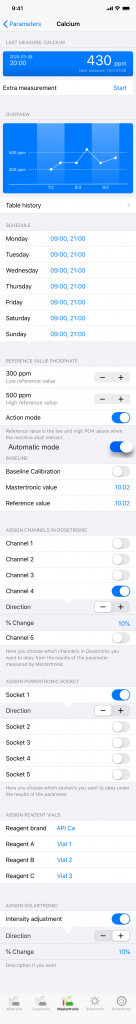
Kort presentation av Mastertronic
så här ser den ut, vi valde att ha samma design som i hela serien. o bredvid en bild från en screenshot från appen, varje parameter har sin meny, här visas Ca. /Jonas
-
Romans Balling 2 part
jag kör mitt egna recept nu men modifierat igen det så det är nu en "Roman Forze7" , alltså 3 ”burkar”, styrka 7 ggr starkare än vanlig balling. NaSO4 kan man prova utan , om man bara kör icp ibland, en del har rapporterat att S ligger rätt även utan Natriumsulftaten, så det står inte o faller med den.
-
Kurera sten med alger
Min uppfattning är att det är aldrig ett direkt ”stenproblem”, då vilken sten som helst i ett balanserat kar med algätare får inga trådalger. Du får se till att systemet är uppbyggt så de inte blir alger. Visst kan du mekaniskt avlägsna alger på en sten men inte till nån större nytta då det kommer bara nya om underliggande orsak finns kvar. Sen är det ett ganska ineffektivt sätt att få bort alger med att lägga sten mörkt,. det kan ta evigheter. Jag hade avlägsnat det värsta mekaniskt om det vare mkt, helt enkelt borstat bort det, o sen introducerat algätare, massor med sniglar, eremiter samt 1-2 kirurger eller liknande som ständigt betar på stenarna. /Jonas
-
Fosfat vs nitrat
Hej, intressant. det kan va så att din DSB inte kommer räcka till. Min var också passiv och blev så småningom för liten, och jag fick komplettera med en nitratreaktor. plenum eller inte vet jag inte säkert då jag aldrig testat med plenum, MEN tror inte plenum behövs. Har du funderat på extern algreaktor? Det ör konstigt att din nitrat ack trots att det växer i refugiet. kanske för litet helt enkelt. Mitt refugium fullkomligt äter upp nitrat o makroalger slukar ju så mkt mer nitrat än fosfat, N/P kvoten är nånstans runt 90/1,. så med tillräcklig växt/skördning, borde du få ner nitraten. Helt ärligt tror jag den vägen är enklare än DSB, såvida du inte har en DSP i hela displayen, men det gissar jag att du inte tänkte. Lasse har ju en smart metod att göra en relativt liten DSB ändå väldigt effektiv i o med att den är mer aktiv med tvingat flöde igenom, men ändå så lågt så redox ligger på låga nivåer. Lite som en Dymico. Men är du inte beredd på en sådan komplex lösning skulle jag i ditt läge överväga en extern algreaktor. Kanske du kan låna en sådan o se om det funkar först. Sen n’är det gäller alger som exportmetod gäller det ju att det inte råder brist på järn, kalium o manganese, som ju algerna också behöver. en variant till är svavelreaktorn. För att vara en nitratreaktor ’är den relativt enkel eftersom den inte kräver matning med kolkälla utan sköter sig helt självt. Den enda du behöver är en pump som matar den, det rör sig om låga flöden som kanske 2 liter i timman, så tex en IKS vario blue pump eller liknande peristaltisk pump för kont bruk. /Jonas
-
Fosfat vs nitrat
Det är ganska vanligt att system är otillräckliga på att ta bort nitrat, på grund av för lite anaeroba zoner. Vi har ganska lite sand , och en del ingen alls (enligt mig sämre och ger med större risk ett instabilt system). Levande sten är halvbra på att ta bort nitrat, för trots allt är det inte jättemycket syrefria zoner i en levande sten som står i hyfsad kontakt med vattnet . Även om stenen är syrefri djupt därinne skall ju näringsämnena transporteras in o ut. vilket dom inte gör så enkelt genom en sten. Så kort sagt, ditt problem är vanligt med dagens set up. Det finns en del akvarium som jobbar med djup sandbädd, och dessa har sällan nitratproblem då sanden när den blir över ett visst djup är utmärkt på att bryta ner nitrat. Lösningen kan vara att installera en nitratreaktor, det finns 2 modeller, svavelbaserad eller kolkällematad. Ett annat är att exportera nitrat med alger, det är mkt mkt effektivt så länge du har bra ljus för algerna samt plats. Saknar du plats kan du köpa en algreaktor. Med dessa metoder kan du få ner nitrat utan att behöva använda kolkälla, som är mkt mkt mer svårstyrt o kan överdoseras(=dåligt). Fosfaten brukar ha en tendens att stiga när du selektivt exporterar nitrat på detta sätt, så med algfiltermetoden får man vara beredd att köra Rowaphos då o då, men det är ju inget problem. Kvoten: Jag tror att ett slutet system som vi har med avsaknad av plankton mår bättre av en betydligt högre N o P kvot än i havet . I havet är den 16/1 men jag tror vi skall ligga i ett slutet system mer på 70/1. Du kan inte ta mg/l o dela för att få kvoten, då kvoten avser antal atomer. Här en en formel hur man räknar ut kvoten utifrån Nitrat o fosfat i mg/l: 1.54*NO3(mg/L)/PO4(mg/l)= N/P kvoten. När du hade 25 i nitrat samt 0.15 i fosfat var således din N/P-kvot: 1.54*25/0.15=256. Det är lite väl högt. Jag brukar räkna baklänges. jag siktar på ett fosfat jag vill ha, o sen räknar ut var ungefär då nitrat skall ligga. För nitrat kan jag doserar. Jag tex har 0.08 i fosfat just nu...då bör mitt nitrat ligga runt (0.08*70)/1.54=3-4 mg/l. Eftersom jag skördar så mkt alger så jag nästan nollar nitraten kan jag nu med nitratdosering styra så jag får nitrat precis där jag vill. /Jonas
-
Kort presentation av Mastertronic
Ljudnivån är mkt låg, ungefär som den sista generationen AT.
-
Kort presentation av Mastertronic
Hej. Kalium kan nog gå men vi har inte testat det än. Lösningarna får ej va för ”kladdiga” så det räcker med sköljning.
-
Ändtitreringspunkt vid beräkning av total alkalinitet
Lasse o jag hade som vanligt en berikande diskussion där vi pratade om vid vilken punkt vi läser av vårat salifert-test eller liknande test, när vi mäter KH. Bakgrunden för er som inte är insatta är att när man mäter total alkalinitet så tillför man en syra, så att alla alkalinitetsbidragande joner konverteras över till sin syraform. De joner som svarar för den totala alkaliniteten i ett marint vatten är till 95% karbonater (vätekarbonat och karbonat) samt 5% av borat. Det finns andra joner med som bidrager till alkaliniteten som tex fosfat, silikat osv men detta kan vi försumma då dessas bidrag är knappt mätbart. Så när vi då tillför en syra, så kommer successivt alltså karbonatjonerna konverteras till kolsyra/koldioxid och borater till borsyra. När man tillfört så mkt syra så att ALLA dessa karbonater och borater övergått till sin syraform, har man titrerat ut all alkalinitet i vattnet och den mängd syra som gick åt för att göra det är samma som vattnets totala alkalinitet innan man började titreringen. Men hur vet man när man nått den punkten när alla karbonater och borater är helt uttitrerade? Det vet man för att då råkar vattnet ha ett visst pH, och det är detta vi kallar för ändtitreringspH. Detta pH har ett visst värde som bestäms av andra kemiska lagar som vi inte behöver gå in på, men det handlar i huvudsak om hur mkt CO2 som ett vatten kan lösa och vilket pH vattnet då får om vattnet har 0 i alkalinitet. För marint vatten är detta pH mellan 4.2-4.5 Traditionellt menar en del att det är pH 4.5 man skall sikta på, men undertecknad menar att i ett saltvatten behöver man nog gå ner ända till pH 4.2 för att ha titrerat ut riktigt all alkalinitet i ett saltvatten(jag har testat genom att göra titreringsdiagram samt i litteraturen figurerar både 4.2 och 4.5). Dock i sötvatten är det utan tvivel pH 4.5 som är ändtitreringspunkten. Denna skillnad beror på att kolsyra övergår lättare till vätekarbonbat i saltvatten, så i saltvatten har vi ett litet större ”tryck” på att koldioxid/kolsyra skall gå över som HCO3. Det är förresten därför som ett saltvatten får ngt lägre pH jämfört med sötvatten om båda vattnen står i jämnvikt mot samma mängd CO2 i luften med samma alkalinitet. Nåväl, Lasse ställde som vanligt en mkt klok fråga, och väckte en intressant diskussion, för när vi titrerar med salifert, vilket pH värde har vi då för respektive färgomslag? När jag utvecklade Alkatronic testade jag detta och fann att vid just pH 4.2 så var röret lila, dvs den färg nog många av oss räknar som omslag. MEN, det finns ett omslag ett snäpp tidigare när provet precis börjat ändra färg, alltså verkligen första antydan till färgändring, och där har vi faktiskt pH 4.5. Det är inte så noga om man skall va ärlig om man väljer pH 4.5(första färgomslaget) eller pH 4.2(ett ”snäpp” senare”) som ändtitreringpunkt så länge man gör samma, då ju trenden är det viktiga. Den praktiska skillnaden i KH mellan dessa 2 olika ändtitreringsunkter är ungefär 0.2dKH. Men detta kan ändå va bra att veta , om man tex läser av salifert så tidigt det går, jämfört med tex en Alkatronic, så kommer Alkatronicen sannolikt visa runt 0.2dKH högre. Inget är mer rätt eller fel, det är bara hur vi väljer att definiera total alkalinitet. /Jonas
-
Funderar på byte av salt
Och här håller jag med Lasse. Ännu en flaska att öppna Lasse;-)
-
Sommarvikarie på alla ICP labb?
Självklart 🙂
-
Sommarvikarie på alla ICP labb?
Jag har skrivit in datumet i kalendern.
-
ATI Essentials Pro
Det är helt korrekt gällande Sr i alla fall, Tritons Balling innehåller för lite Sr, hittills vet jag ingen som inte behövt stöddosera och eftersom Sr förbrukningen är mer eller mindre hand i hand med KH/ca är det enligt mig en felaktighet i det receptet. ATI PRO ( o mitt eget recept med flera) ligger spot on på Sr, och visst har detta betydelse, du tvingas ju låsa upp en hel doseringskanal till, samt en betydande kostnad för Sr tillsatser, samt en tillagd osäkerhet eftersom om du inte mäter ICP ofta vet du inte. Kalium finns ingen Balling som innehåller mer som lite ”rest”produkter för att egentligen tillsätta ngt annat, tex jod, där man då får kalium på köpet, men det är försvinnande litet. Kalium är det meningen att man alltid skall tillsätta bredvid OM det behövs. I övrigt tycker jag tritons balling håller måttet, o då jag blandar Sr själv samt har 10 kanaler är det för mig inget problem, men kan definitivt se nackdelarna för många andra. /Jonas
-
Tillsatser
Testade formeln ännu värre än jag sa: jag låtsas att pH elektroden mäter fel med bara 0.05 pH. Då blir det ett fel på det uträknade KH värdet på 1.0dKH!
-
Tillsatser
Rotade fram detta bland mitt gamla arbete. testa o se hur lite det krävs att ändra H(pH) för att få ett stort ”fel” på KH. minns inte exakt men tror jag kom fram till att kan man inte mäta pH med i alla fall 0.02 noggrannhet får man rätt grova fel på KH.
-
Tillsatser
Ja det finns ju 3 sätt att räkna /mäta karbonatalkan. 1) titrera 2) surgöra o mäta CO2 ökning 3) mäta CO2 innehåll och pH. Vet man 2 kan man räkna ut den tredje. Denna metod är en andragradsekvation och jag kan visa dig om du är intresserad. där ser man att det krävs en otroligt hög noggrannhet på både CO2 och pH mätningen för att få ett exakt KH värde. Mer eller mindre omöjligt med normal utrustning. Minns att jag rökande på detta o tror det var så här att CO2 mätningen måste va minst inom 5 PPM och pH inom 0.02 för att få en noggrannhet på 0.1 dKH. Fortfarande inte så bra med andra ord.
-
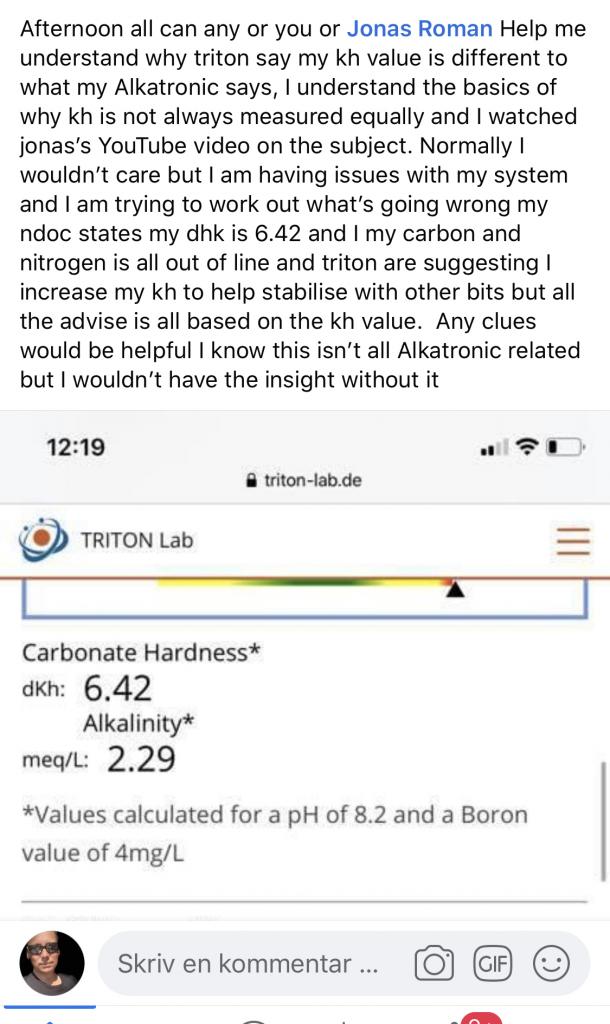
Tillsatser
Här är ett av alla exempel som ramlar in med beräknade ”total” Alka värden från triton som inte blir rätt. . Så hur du än vrider o vränger på detta Lasse så blir det inte rätt när Triton räknar fram den totala alkaliniten. O det är väl ändå vitsen att det skall bli? O skälet menar jag fortfarande är pgr av att dom mäter karbonatalkan (vet ej hur dom exakt gör men gissar att dom surgör o sen mäter CO2 skillnad) men den varierar ju med pH så det blir inte samma värde som hemma hos dig o sen på det lägger dom dessutom på boratalkan som en konstant så även den blir aldrig helt rätt. Därför blir deras uträknade totala alka nästan alltid fel. Visst blir det rätt om pH värdet är 8.2 o Boron 4 men då måste ju triton se till att vattnet har ph8.2 innan dom mäter karbonatalkan med den metod man gör det (surgör, mäter CO2). Skulle dom göra på det andra sätter bara mäta totalt kol o sen räkna ut karbonatalkan som om pH vore 8.2 ja då är det ju inte relevant att ens prata om att ”vid pH 8.2” för total alka är oberoende av pH. Då blir nämligen boratfelet lika stort som karbonatfelet fast i olika riktningar. Det för mig att tro att dom inte alls räknat ut även karbonatalkan utan den mäter dom men Borat alkan räknat dom ju ut. För annars hade det blivit mer rätt. Jag menar o det ser vi ju för alla prover jag sett hittills är ju inte rätt!, att dom borde göra på ett annat sätt o reda upp detta lite. Antigen bara mäta innehållet av total oorganiskt kol , så får man göra vad man vill med den infon som ju är ny o kanske intressant info , eller titrera ut total alka o sen kan ju kunden själv jämföra detta med den av dom mätta karbonatalkan o se hur mkt boratalka man tydligen har. (Rätt ointressant dock). Så första varianten är väl mest spännande?
-
Hanna Nitrat (NO3) checker på G!
Mer en språkfråga kanske. Bara man vet vad man menar o de vet jag att du vet såklart. Jag har inte hittat en enhetlighet i nomenklaturen för tex colorimeter sätts likhetstecken med photometer ibland. Men kolorimeter kan också tolkas o enligt mig mer korrekt som en RGB mapping procedur. Alltså du sänder ut RGB o sen mäter reflektionen på dessa tre o får en RGB kod , alltså en ren färganalys. Därför anser jag att fotometer är det mest rätta för vad Hanna checkerna gör och spektrofotometer är de mer avancerade där du kan analysera en vätskas absorbering gällande alla våglängder då du får en spektralkurva. En spektrofotometer kräver ju en annan hårdvara. Prisma eller flera bandfilter. Nåja, det är som sagt en språkfråga så så länge man specar vad man menar är det ok. Jonas
-
Tillsatser
Jag förstår att dom räknar ut det utifrån ett antagande att pH är 8.2 (och B 4 ppm), men det blir 2 fel på det viset, och det är det jag försöker säga: Man kan inte se detta som ett referensvärde när man räknar ut ett prov baserat på ett mätvärde. Det blir en extrapolering som bygger på ett antagande som aldrig helt kommer stämma. Minsta lilla du INTE har ph 8.2 så blir ju deras svar ganska så mkt fel. Hur kan du då anse att detta är användbart som ett referensvärde? Som Totalt kol är värdet intressant men som alkalinitetet helt värdelöst. För det är jiu inte så Lasse att om du då har ett pH på 8.1, så kommer triton räkna om värdet utifrån det pH du hade vid provtagning(8.1). Isåfall borde dom ha ett program där du knappar in ditt pH, men då kommer en felkälla in till, för att ett KH värde skall bli tillförlitligt baserat på ett känt pH samt känd halt av totalt Kol, krävs en pH noggrannhet på 0.01. Redan vid ett fel på 0.02 får du ett rätt stort fel på uträknat KH värde, så det skulle aldrig fungera. säg att du har pH 8.2 vid provtagninstillfället, JA då rent teoretiskt stämmer deras uträkning, MEN du har inte ph 8.20...du har väl i bästa fall en ph mätning med 0.05 noggrannhet, o för det andra så kommer den ju aldrig ligga på exakt 8.2, så hur du än gör kommer tritons extrapolering komma snett, då dom utgår ifrån en situation som i princip aldrig gäller. Återigen, om vi kollar på karbonatalkan då, som du säger dom korrigerar för pH avvikelsen mellan provet när det anländer samt ph 8.2, det räcker att ditt verkligen pH där hemma diffar med 0.1 pH ifrån 8.2 som dom använder i sin formel, så kommer de uträknade värdet på karbonatalkan bli 0.5dKH fel eller så. Jag räknade på detta när jag valde mellan olika sätt att mäta KH. Detta stämmer också empiriskt med de data jag sett, när vi jämfört Tritons uträknade KH gentemot det sanna (total alka). Triton hamnar nästan jämnt rejält under, trots att dom lägger på en förmodad Boratalka på 0.3dKH. Det blir så att säga 2 fel, dels är själva karbonatalkavärdet från triton lite eller mkt fel eftersom det utgår ifrån ett pH på 8.2 som du aldrig exakt har, dels blir boratalkan som dom bara adderar också lite fel, eftersom även den utgår ifrån ett ph på 8.2 som att du har B på 4 ppm. Just B på 4 ppm måhända vara en okej approximering, då den biten inte spelar så stor roll, men ph värdet har stor impact vid minsta avvikelse från 8.2. Jag tror inte Triton kan komma undan med detta för det räcker inte att be användaren att säga sitt pH för då blir det ju en ordentlig felkälla till (se ovan). Jag tycker dom skall hålla sig till att bara ange totalt oorganiskt kol, o se det som ny information vi aldrig kunnat få förut. /Jonas
-
Tillsatser
det stämmer, men karbonatalkaliniteten av denna portion är ju bara HCO3+CO3, o den relationen ändras i provet, så Triton kan bara veta den total mängden C(den ändras ju inte som du säger), samt hur mkt som ”just nu” ligger som HCO3+CO3. Der är ju inte samma som när du tog provet. Den relationen H2CO3/(HCO3+CO3) ändras ju med pH, o därmed ändras karbonatalkan med pH. Lek med tanken att det prov som triton får under resans gång hart ett ph på bara 5 (extremt men bara som exempel): DÅ kommer allt oorganiskt kol ligga som H2CO3 (nästan), så det provets karbonatalkalinitet är nästan 0dKH.. på detta värde lägger dom på en konstant, Boratalkan (den blir ju en konstant i tritons fall eftersom dom räknar med B på 4 ppm o ph 8.,2, det är ju samma som att lägga på ett o samma fasta värde på Boratalkan, nånstans runt 0.3dKH). Ja då kommer det provet i deras PDF svara ut med Total alka på 0.3dKH. Detta var ett extremfall, men det belyser att provet är i min värld ganska värdelöst. MEN däremot är det ju intressant med total mängd oorganiskt kol, alltså H2CO3, HCO3+CO3.
-
Tillsatser
precis, det är ju det jag säger.
-
ATI Essentials Pro
precis, uppgiften jag fått är från ett företag som mäter NDOC ofta o utifrån det börjat misstänka att ATI PRO innehåller kolkälla. Man kanske kan fråga dom helt enkelt ?
-
Törs man lita på svaret ifrån Tritontestet?
exakt, det är viktigt att skilja på att det Triton gör i sak är superbra, och HUR dom gör det. Det senare kan bli bättre emellanåt. Tex deras KH grej, där Lasse o jag tjafsar, men är ändå överens om att dom borde nöja sig med att svara ut det dom mäter, karbonatalkalinitet, o inget annat. /Jonas
-
Tillsatser
Vad jag skulle vilja att dom istället gjorde är ju antingen 1) bara svarat ut med det dom mätt punkt slut så att säga. Alltså karbonatalkan OCH förklarat att detta är inte den totala o kommer alltså alltid vara en del lägre än hemmatesterna även om hemmatestet visar exakt rätt. Vad man sen skall med den infon till går ju diskutera. Ser inget omedelbart användningsområde men svaret blir i alla fall rätt. Kanske för den där nya kvoten organiskt kol /oorganiskt kol. 2) eller om om man nu verkligen vill ge kunden Total alka, två olika sätt A) mäta karbonatalkan o svara ut den. Mäta Boratalkan , dvs mäta provets pH och Borat halt exakt när provet är hos triton. sen svara ut med respektive delsvar och den totala. Så blir deras totala alka alltid rätt o kan tjäna som ett referensvärde B)Titrera ut alkan o svara ut den. O karbonatalkan har dom ju mätt så DÅ kan man bara ta differensen o få den korrekta Borat Alkan. Enklast o sannolikt mer exakt än metod A. Då skulle dom få en fördel gentemot ATI som bara titrerar ut total alka men ej mäter den inbördes bakomliggande relationen KA/BA. men triton gör inte så o därmed stämmer det inte alls som triton gick ut med för 2 årsen att detta provets funktion skulle kunna vara att se om ditt hemmatest mäter rätt. vet inte om dom bara tänkt fel eller misslyckats i sin pedagogik. Jonas