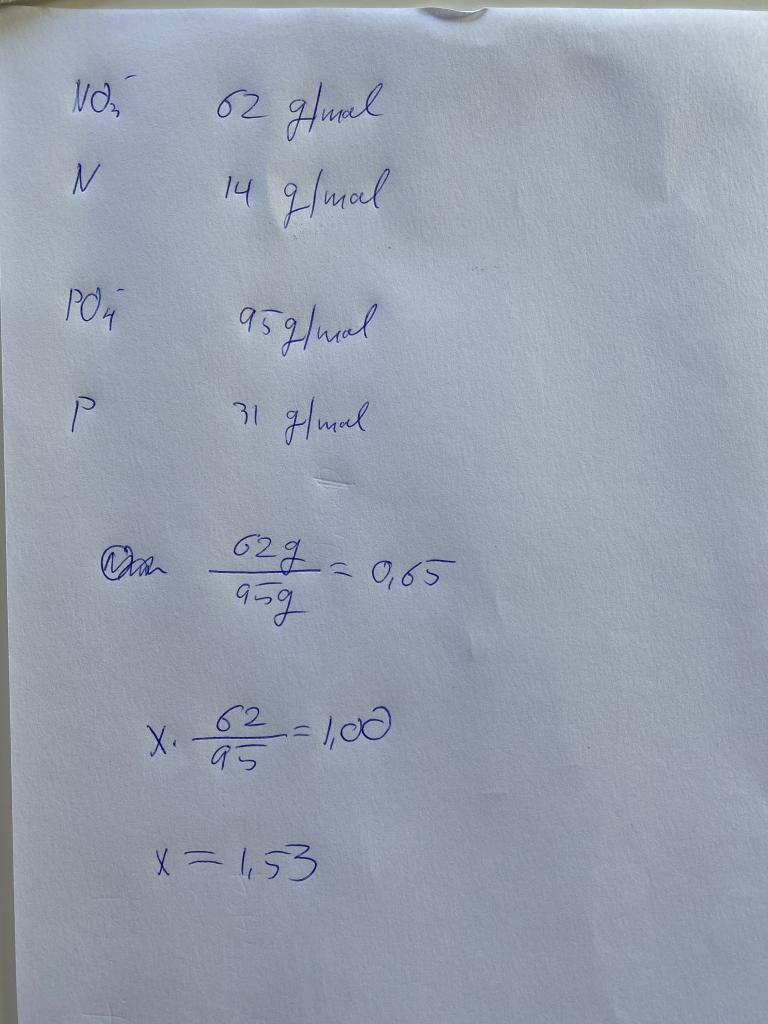All aktivitet
-
För och nackdelar med vattenbyte?
låter mer som jag trodde ”från förr”, men då tycker jag dom skriver en smula opedagogiskt.....först säger dom en kvot: 1:3....o sen skriver dom NO3/N......det tolkar jag som att 1 an är NO3 och N är 3 an...varför byter dom plats på täljare o nämnare helt plötsligt?...eller vad missar jag här?
-
För och nackdelar med vattenbyte?
kjelle det är ungefär vad jag försökt visa med min formel idag;-) som sagt, du behöver bara ta dina värden i ppm som du är van vid, så kan du se vilken NP kvot i mol det blir (den rätta enheten) ELLER om du som lasse ovan har ett värde på PO4 o utifrån din idealkvot vill räkna ut vad du då skall ha i nitrat. bara o vända på formeln, 2 kända o en okänd. 1.54*NO3(ppm)/PO4(ppm)=NP kvoten i mol ratio så lasse exempel med att vid tex har 0.1 ppm i PO4, (och kanske är nöjd med det), och säg att vi anser att NP kvoten 70 är bra , ja då skall nitrat ligga runt: 70*0.1/1.54=4.5 ppm men som vi idag diskuterat lite, eftersom allt kväve ligger inte som nitrat, men det är ju nitrat vi mäter, får vi uppskatta hur mkt totalkväve vi har ( om man inte skickat in till triton). Det blir en ren gissning men en icke dålig sådan baserat på önskekvoten N/NO3 på 3 är att det i alla fall ligger lika mkt som annat kväve än nitrat. Då blir kvoten 140 istället om vi antar att lika många mol som 4.5 ppm nitrat utgör, ligger också som annat kväve. Men för oss då som bara mäter hemma, får vi alltså tillverka oss en kvot som bygger just på NO3 halten, då vi inte har totalkväve. Då känns det rimligt som en kompensation för avsaknad om vetskap om totalkväve, att sänka kvoten lite, till alltså ungefär 70-100. när jag ser i mitt kar ligger jag nog alltså runt 70 i kvot(baserat på nitratkväve), men skulle jag skicka in till triton o allt kväve inkluderas, hamnar jag kanske runt 100. Oavsett, den gamla redfield på 16/1, det tror jag är på tom för lågt i ett slutet system. Det var där vi började denna intressanta tråd. /Jonas
-
För och nackdelar med vattenbyte?
Då mindes jag rätt, att så mkt som 3/4 ligger som annat kväve än no3. men de klart, det organiska är ju med också, så det kanske inte är så konstigt. Men hur har dom fått fram att 1/3 är den ideala kvoten? empiriskt, eller är det så det är i havet? Jonas
-
För och nackdelar med vattenbyte?
precis, 1.54 faktorn fixar till det. Det var änna hela grejen:-) ja, det är intressant att tritons kvot är lik den jag själv också märkt fungerar väldigt bra. Alltså visst kan man ta vikterna direkt o strunta i 1.54, det blir ju en faktor det med med bara andra o nya referensvärden. Men eftersom standarden är mol ratio, och det vi jämför med är rex redfield 16/1, eller kanske tritons 70/1 osv, så ville jag mest göra en enkle formel så "akvaristen därhemma” kan direkt översätta sina värden till en korrekta molbaserade N/P kvoten. Men så länge man vet vad man har för enhet, samt vilket referensvärde man vill ha, kan man förstås göra som man vill. För mig säger inte en viktkvot något direkt, för det är av en ”valuta” jag inte är kalibrerad i. Lite som att vara utomlands...man räknar om allt i svenska kronor för att få ett begrepp. Samma här, med min faktor får man den rätta enheten vi lärt oss. en sak, kanske du vet eller har en kommentar: N/NO3 kvoten är ju en ny grej, i o med att vi kan få totalkväve från triton, samt i bästa fall själva till det addera ett nitratvärde vi mätt själva. ...vad anser triton vara den ideala N/NO3 kvoten?...3? din kvot ovan är 2 om jag räknar om det i mol, ser väl bra ut isåfall? Kan du upplysa mig om deras idealkvot för N/NO3 samt om du vet varför den är som den är vore det ett intressant uppslag för mer tankar o diskussioner. I min värld, men det kan va fel, ligger mer än bara en tredjedel som nitrat av totalkvävet, men så kanske det inte är? Alltså om jag hade fått gissa trodde jag N/NO3 kvoten mer låg åt 0.3...men jag har aldrig mätt totalkvävre (såklart) så det är en ny kunskap. (Och intressant). /Jonas
-
För och nackdelar med vattenbyte?
@Lasse, jag tar ett exempel som visar att min formel allt skall fungera: Nu gör vid det enkelt: 0.5 ppm nitrat 0.1 ppm fosfat Min formel: N/P = 1.54*0.5/0.1=7,7 . alltså: N/P kvot 7,7 (I atomer, som det ska va) Nu räknar vi ut den på vanligt sätt för o kolla om min formel är rätt: 0.5 ppm nitrat=0,00809mmol/l 0.1 ppm fosfat=0,00105mmol/l N/P kvot i mol: 0,00809/0,00105=7,7! samma! det är det som är grejen med min omräkningsfaktor 1.54, det är den som gör om det till molförhållande när man matar in viktförhållandet! /Jonas
-
För och nackdelar med vattenbyte?
Det fungerar. Kolla själv. Det är ju det som är grejen, att köra vikten direkt men tack vare faktorn 1.54 blir det mol-ration. I 1.54 ligger inbakat relationen vikt vs mol för nitrat o fosfat. Det var därför jag tog exemplet med vikter som är samma som motvikterna så man enklare skulle förstå hur jag får fram 1.54. Närt vikt delas med vikt får vi en enhetslös kvot, alltså en ratio, så det är bara att hitta faktorn, o den blir alltså de två ämnenas molvikter delat med varann. 1.54 Jag kan visa med ett exempel nedan så ser du att den fungerar. /Jonas
-
För och nackdelar med vattenbyte?
Min formel utgår ifrån att nitratvärdet är just bara nitrat och ett sant värde samt att kvävet kraftigt dominerar som nitratform. Bakar du in allt kväve, totalkväve, blir naturligtvis N/P kvoten lite högre. Triton vet ju förresten inget om nitraten dom ger bara totalkväve men ur en NP kvot synvinkel är ju det intressant och ger en ännu mer korrekt NP kvot. Att förenkla o anta att nästan all kväve ligger som nitratkväve menar jag är gott nog när vi skall räkna på kvoten. Jonas
-
För och nackdelar med vattenbyte?
Ser inget fel trots din hint. I nitrat har vi en atom kväve , NO3 och i fosfat en atom fosfor , PO4 , så X mol nitrat innehåller X mol N atomer o samma med fosfat.
-
För och nackdelar med vattenbyte?
Nu har jag rättat mitt räknefel i primärinlägget, o använt min egna formel rätt. haha. Både Lasse o Kjell har tryckt på rätt knapp och mkt riktigt blir kvoten runt 100 i det exemplet med 2 ppm i nitrat o 0.03 i fosfat (1.54*2/0.03=103), helt rätt! Så jag korrade mitt räknefel och i exemplet då med 0.03 ppm i fosfat landar ju nitrat på 1.4 ppm för att få kvoten 70. 1.54*1.4/0.03=70(cirka). Så, nu blev det rätt. Självklart menar jag inte att det är noga att ligga på exakt 70, det är ju för det första omöjligt då vi inte kan mäta nitrat så exakt, men jag tänker mer som ett riktmärke och att i alla fall är inte redfieldkvoten 16 ngt jag tror på. Med den kvoten skulle vi ha extremt låga nitratvärden trots inte ultralåg fosfatdito, o det har jag sett många kar som blir instabila på, samt också rätt dassiga koraller på det. tex om vi då har tex 0.03ppm i fosfat så skulle vi enligt redfield (vi använder min formel baklänges), ha nitrat på : 16*0.03/1.54=0.3 ppm nitrat. Alldeles för lågt enligt mig....så nån 16/1 kvot tror jag inte på. Jonas
-
För och nackdelar med vattenbyte?
kolkälla;-)
-
För och nackdelar med vattenbyte?
nej....;-), jag tror allt min formel är rätt. grejen var bara det att Lasse inte fick ihop var att vi fick olika kvoter men det var för att jag skrev fel i mitt första inlägg då jag glömde multiplicera med min faktor 1.54. Använder jag min formel rätt blir kvoten 102, och det stämmer allt. Räkna om allt i mol så får du se, det är enkelt här då ju en mol fosfat innehåller lika många mol P som det finns N mol i en mol nitrat. /Jonas
-
För och nackdelar med vattenbyte?
nu ser jag missförståndet. Du använder formeln rätt. Och formeln är rätt. N/P kvoten blir 103 i mitt fallit lite längre upp(som du räknat rätt), om man kör min formel. Jag missade att ta med faktorn 1.54 i mitt primärinlägg, när jag slog på miniräknaren. @Lasse /Jonas
-
För och nackdelar med vattenbyte?
jag räknar om ppm i atomer. Ex: Molvikt nitrat: 62 g/mol Molvikt Fosfat: 95 g / mol Säg nu att vi har kvoten 1.00 , alltså N/P kvoten räknat i atomer. För att göra det enkelt, innehåller vattnet 62g/l nitrat samt 95 g/l fosfat så blir N/P kvoten i atomer räknat 1.00. för 62 g nitrat är lika många mol N som det är mol P i 95 gram fosfat. okej, så kvoten blir 1.00 om vid har dessa viktkoncentrationer. så: X, som är vår omräkningfaktoir: X*(62/95)=1.00 X=1.53(avrundat slarvigt blir egentligen 1.54 som i min ursprungliga. Så alltså 1.54*Nitrat(i ppm)/Fosfat i ppm=N/P-kvoten i atomer räknat /Jonas
-
För och nackdelar med vattenbyte?
du är inte dum, säkert jag som inte förklarat tillräckligt:-) I min formel finns det omräknat till antal atomer N o antal atomer P utifrån det värden en akvarist får, mg/l. Det är det som ligger bakom 1.54 siffran. Så tar man 1.54*nitrat i ppm o delar det med fosfat i ppm, då får man sin N/P kvot räknat i atomer (som ju är det rätta när man talar om N/P-kvot). Det är just i 1.54 som hela denna omräkningprocedur är inbakat i. jag kan visa hur jag härlett 1.54 om du vill, men inväntar ditt svar så du först förstår hur man skall använda formeln Så N/P kvoten(i atomer räknat) i mitt ex blir 66. (cirka) /Jonas
-
För och nackdelar med vattenbyte?
klokt inlägg @Lasse, köper det.
-
För och nackdelar med vattenbyte?
precis, vi ser bilder, men det kan finnas mkt trubbel bakom för det:-)
-
För och nackdelar med vattenbyte?
jag är också lite fundersam över hur omfattande deras koppling är mellan prover och hur respektive akvarium mår. Jag vet inte nån eller har hört talas om nån som fått ett frågeformulär från Triton att inkludera karets kliniska status ihop med inskickat prov. Med all den databas dom har borde det finnas massor av kunskap. Internet idag gör ju processen ganska transparent och inte nånstans har jag sett läst eller hört något sådant test. Så, är det en relativ inhemsk studie Triton gjort? Jag ifrågasätter dom inte, men frågan är högst relevant. I vetenskapens värld skall man kunna redovisa vad som står bakom sina påstående. Jag mailade triton för flera åren o tipsade om att dom kunde inkludera ett frågeformulär som man inkluderar ihop med inskickat test, tex såsom cyano, dino, eller andra problem. Men ngt sådant har inte implementerats och jag fick inte svar på mailet. Så denna undersökning måste nog vara hyfsat lokal o begränsad trots allt. Jag vill såklart tro att det finns studier bakom, men givetvis är vi nyfikna hur var o när då ingen sett fått eller hört talas om dessa frågeformulär, och det är ju våra data som använts. /Jonas
-
För och nackdelar med vattenbyte?
ja, strontium är det för lite av i core7. Lite märkligt faktiskt, då det följer Ca konsumptionen ganska linjärt.
-
För och nackdelar med vattenbyte?
ja naturligtvis. men då får du dubbla dosen från den kanalen, eller späda de andra med 50% till en ”core3.5”, men visst, det går ju fint:-)
-
För och nackdelar med vattenbyte?
du läser min formel fel. Du skall stanna vid 66,66. Du gångrar felaktigt med 1.54 igen. N/P kvoten i ditt(mitt) exempel är alltså 66,66. /Jonas
-
Dospump som doserar fel
du har dock ej bytt själva motorn?
-
Dospump som doserar fel
Tyvärr är detta nog vad du får räkna med när det är brushed DC motorer som är gamla. Jag har haft denna pump för länge sen o själva koden bakom är nog inte felaktig(fast vem vet, men det låter helt enkelt osannolikt). Sen finns ju ett fel i mätglaset med, men såklart inte på 15 ml, så det förklarar ju inte ett så stort fel. Jag tror det enda är att prova med en ganska ny sådan maskin. /Jonas
-
För och nackdelar med vattenbyte?
Intressant diskussion om N o P. för den som vill slippa räkna själv har har gjort en enkel formel för att omvandla dina nitrat o fosfat värden till NP kvot. Som ni vet avser ju NP kvoten antalet atomer. Så man får räkna lite med molvikter o annat o då blir det så här: 1.54* nitrat /fosfat = N/P kvoten nitat o fosfat i ppm jag har haft alla möjliga kvoter o alla möjliga problem och sista tiden mätt väldigt frekvent. Mina iakttagelser är att ett slutet system mår som bäst om 1) NP kvoten ligger en bra bit högre än naturen. Runt 70 har jag märkt att systemet är stabilt(ingen cyano, ingen dino). Jag tror skälet att ett slutet system behöver högre kvot än naturen är för att vi har så mkt mindre plankton. Slutna system har en helt annan näringsbalans. 2) kvoten ovan endast så länge de absoluta värdena är rimliga. Dvs om tex nitrat är 20 skall man inte sträva efter kvoten i första hand då absolutvärdwt är för högt. Så prio 1 är att få absolutvärdena inom sitt respektive toleransfönster och därefter finlira med kvoten. för mig är de ”terapeutiska” fönstrena ungefär : fosfat :0.02-0.1 (men idealt 0.03) nitrat därefter då enligt kvoten 70 dvs mellan : 1-5 ppm det finns kar med superhögt fosfat men ändå ganska snygga o stabila. Då säger jag det som jag alltid sagt : 1) hur hade dom sett ut med 0.04 i fosfat ? Kanske ännu bättre? Saknas kontrollgrupp 2) orsaken att enstaka kar funkar med så högt fosfat är nog att dom kompenserar med ngt som tex massor med koraller och mkt mkt ljus. Då kan man gå upp i fosfat utan att det blir tydligt sämre. Inget att rekommendera således för gemene man. Till sist: sen denna kvot och i viss mån absolutvärdena gått upp för mig är ideala, har jag drivit mitt kar målmedvetet med 0.03 i fosfat o alltså nitrat därefter (1.4 ppm, men naturligtvis inte så exakt noga) i enlighet med kvoten 70 genom att först exportera ”all” nitrat via refugiet och sen dosera nitrat. Då kan jag styra kvoten och absolutvärdena som med en volymratt. Och!, karet ser bättre ut än det gjort någonsin under mina snart 30 år inom hobbyn. 100% utfärgning på alla koraller. Inga dödsfall sen länge. Sanden vit. Enorm tillväxt. Och inget annat är ändrat än just detta. ja, stabilt KH förstås;-), det är A o O. för mig är saken ganska klar. Jonas
-
För och nackdelar med vattenbyte?
AMI ingen skillnad. Vad som finns i en Balling är känt långt innan Triton fanns. För mig är core 7 dock ett bra alt av dessa skäl fördelar : 1) jag är lat, dvs jag gillar de färdigblandade 5 litarna. Utan dom faller den största fördelen för mig. 2) jag litar på att kvalitén på de klassiska kemikalierna är hög. Köper jag o blandar själv måste jag kvalitetssäkra själv. Ett osäkerhetsmoment mindre. 3) vid höga doser praktiskt med ggr 7 4) för refugium finns en variant , så lite extra av sannolikt Järn o manganese nackdelar 1) dyrt 2) 4 pumpar. Onödigt. Man kan antingen köra lite svagare o köra 3 eller t.o.m. med 2 om man kör en 2 parts balanserad (som Ati eller tex mitt eget recept) 3) vid små volymer onödigt med ggr 7 då doserna blir små=lägre noggrannhet 4) innehåller för lite strontium. Du behöver nästan alltid köra det extra. Jonas
-
Konstiga nitratvärde på tester och icp!?
Ang fosfat o Hanna. Precisionen är ju ganska låg i o med att det finns så många variabler där använderen gör olika. Precis som mångas erfarenhet att värdena kastas mellan +- 0.04 PPM eller ännu mer. Man kan ju som en del gör utföra flera mätningar efter varann o ta medelvärdet för att jämna ut dessa precisionsfel. Men i praktiken är det väl ändå ganska obrukbart med en metod som kräver 10 mätningar för att du skall få ett värde att lita på. AMI har då den mätmetoden ej uppfyllt kriterierna för användarbarhet. Jonas