All aktivitet
-
Rowaphos (GFO ) sänker KH.
Precis, det talar alltså för att RP innehåller järnklorid, då järnklorid pgr av sin lättlöslighet sköljs bort om man sköljer i vatten. Troligen är det denna effekt dom vill undvika. Jag har vetat sen länge att dom rekommenderar just detta att inte skölja men förstår nu först varför.
- Rowaphos (GFO ) sänker KH.
-
Hållbarhet på ballingprodukter i blandad form?
Om kärlen är slutna lär hållbarheten vara mkt lång, kanske år, men öppna kärl skulle jag inte rekommendera. Inte minst KH lösningen kommer "tappa" Kh med tiden, då en del av lösningens karbonater går över till CO2. Du ser själv att i din KH behållare bildas mkt bubblor, eller hur?.
-
Rowaphos (GFO ) sänker KH.
Tror faktiskt du inte ens behöver addera NaHCO3 utan det räcker att du låter Järnkloriden komma i kontakt med vatten. För det som då sker även vid vanligt vatten är att kloridjonen släpper direkt o det trevärds järnet tar upp hydroxidjoner o bildar järnhydroxid samt vätejoner.
-
Rowaphos (GFO ) sänker KH.
Nej det borde man inte göra. Om det nu finns järnklorid så blir det som sagt snabbt till järnhydroxid och järnhydroxiden är ju den molekyl sen som utgör verkan genom att binda upp fosfatjoner och samtidigt kasta ut en hydroxidjon. Så ditt test gör kanske bara så Järnkloriden övergår till GFO o därmed slipper man den kH sänkande effekten sen men har kvar den fosfatbindande. Jag tror det borde funka men det kan va givande att höra vad @Lasse tror om den saken också. Jonas
-
För högt fosfat tror jag hämnar kalkbildning
Absolut Stig kan de va så. Det som jag tror talar emot att chemiclean stör direkt är att jag tror ändå att antibiotika är rätt snällt mot koraller o känns inte helt självklart att det skulle i sig stressa dom. Men ett fosfatutsläpp och utsläpp av toxiner från cyano tror jag mer direkt kan störa. Men vem vet, det viktigaste är att vi see sambandet. Så din nummer 2 gissar jag mest på. Just nu. Kan ändra mig;-)
-
Rowaphos (GFO ) sänker KH.
Absolut. Det behövs mer test. Men ett test var att jag redan gjort var att jag la ner Rowaphos i isolerat vatten. Mätte kH o pH 15 min senare: kH sjönk med 1.5dkh och pH sjönk med 0.2 direkt. mvh Jonas
-
Rowaphos (GFO ) sänker KH.
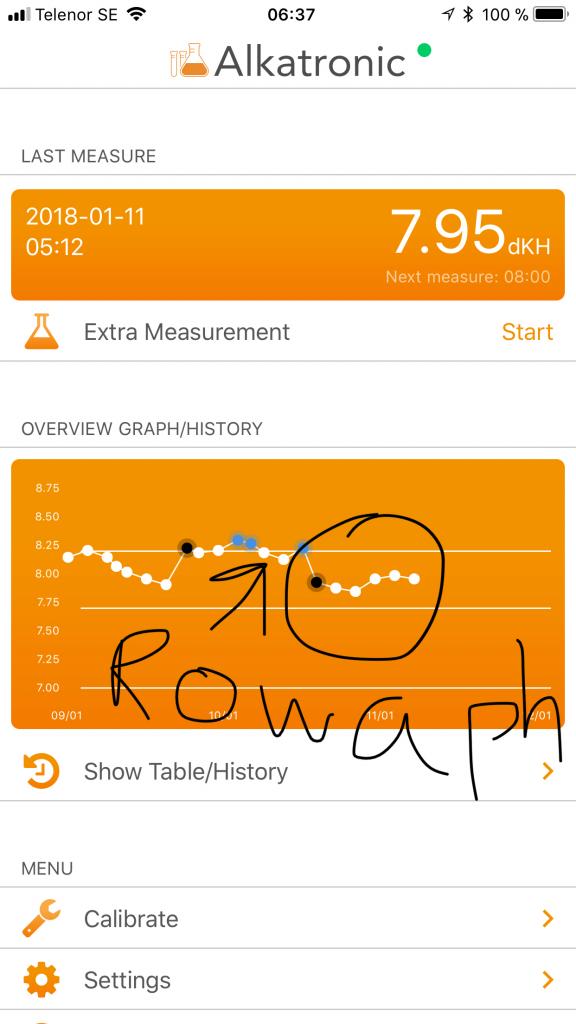
sen vidare: den kontinuerliga nedgången strax före (em 9 jan) är ett uttryck för den vanliga KH konsumtionen på dagen. Sen har vi en sak till som är intressant: kurvan ovanligt rak ända fram till kl 12 am, trots att kalkreaktorn har stängt av (blå punkter), vilket kom i samband med att fosfat steg efter att i sin tur cyanon dog. Det tolkar jag som att den stigande fosfaten( 0.2ppm) tillfälligt bromsat upp kalkbildningen en smula. Vid den tidpunkten nämligen där linjen nu är rak, går alltid KH kurvan ner tydligt men här är den rak trots att kalkreaktorn dessutom är avstängd. Mina tankar kring det här är att 1) GFO innehåller FeCl o därmed har en betydande akut sänkande effekt på KH, och det är i sig inte en betydelselös biverkan 2) Högt fosfat, i alla fall så högt som 0.2 ppm o när det kommer snabbt, hämmar kalkbildningen 3) chemiclean stressar koraller tillfälligt så kalkbildning avtar (syns ej i denna kurvan, här är det mesta av chemiclean i sig borta nu. samband 1 har jag även visat experimentellt i separat kärl, (du inspirerade mig med din vetskap om att detta sker med järnklorid) samband 2 har jag sett 2 ggr nu på kort tid samband 3 är jag mer osäker på, kan va andra effekter av chemiclean också, såsom störd bakterieflora, eller en direkteffekt av preparatet (vi vet ju inte allt vad det innehåller) Jonas
-
Rowaphos (GFO ) sänker KH.
pilen pekar på när jag satte in Rowa. Pilen är inte satt helt exakt, svårt på telefonen. kl 12 am, 10 jan, satte jag in Rowaphos dvs exakt efter den sista blå pilen. En mätning sedan 2 timmar senare hade KH gått ner med 0.3dKH. /Jonas
-
Rowaphos (GFO ) sänker KH.
Enligt en del teoretiska modeller kan GFO på sikt sänka KH. Men att det också sänker KH akut på ett rätt betydande sätt var nytt för mig (och för Dr Randy Holmes i USA). Detta har jag märkt att det gör tack vare min nu kontinuerliga KH mätning. Den långvariga kH sänkningen förklaras sen tidigare (av tex just Randy i hans artiklar) av eventuellt ökad kalkbildning i mediat som kan klumpa ihop sig, detta i sin tur orsakat av att GFO släpper hydroxidjoner samt en del andra sekundära mekanismer. Men så länge mediat bara innehåller järnhydroxid/oxid, ja alltså det som det påstås innehålla, så skall det inte kunna ha en akut direktsändande effekt på KH. Snarare tvärtom. Men!, det har det! För att det skall kunna ske kan det tex vara så att medlet innehåller även Järnklorid. Järnklorid kommer snabbt som tusan ta upp hydroxidjoner o bilda järnhydroxid. Och där har vi isåfall förklaringen varför i all fall Rowaphos sänker kH (och pH) ganska omedelbart vid kontakt med saltvatten. Effekten är inte obetydlig och eftersom kH är en av de viktigaste parametrarna att hålla stabilt över både kort o lång tid är detta i alla för mig en ny vinkling på GFO , och jag hade inte upptäckt detta om det inte vore för min kontinuerliga KH mätning. Är det detta som är en delorsak till varför en för hög dos med GFO kan skada korallerna!?... borde det inte stå på produkten att den isåfall innehåller även Järnklorid?..eller åtminstone att den har en direkt sänkande effekt på kH och pH? )(avser ej långtidseffekterna). Hade jag (eller min maskin just här) nu inte sett detta och Buffrat upp allteftersom min GFO äter upp viss alkalinitet...hur hade mitt kH sett ut då om 1 vecka?? Nåt att tänka på kanske vid stora doser av GFO:-) Jonas
-
För högt fosfat tror jag hämnar kalkbildning
precis, ds det ryms väl ingen järnklorid i den benämningen?..eller menar du att kloridjoner kan bakas in i järnoxiden?:-) Det jag menar är att om det innehåller järnklorid också så skall det stå. Det är inte säkert att det är nåt dåligt med det, men vi skall veta vad vi stoppar i karet, särskilt om det drar ner KH som är en viktig parameter. Den kunskapen kan ju tex medföra att man är ännu mer försiktig samt mäter just KH lite tätare under en Rowaphosbehandling. Det gör nog ingen idag för vi visste inte. Vi har nu kanske lärt oss ngt nytt...i alla fall jag. Jonas
-
För högt fosfat tror jag hämnar kalkbildning
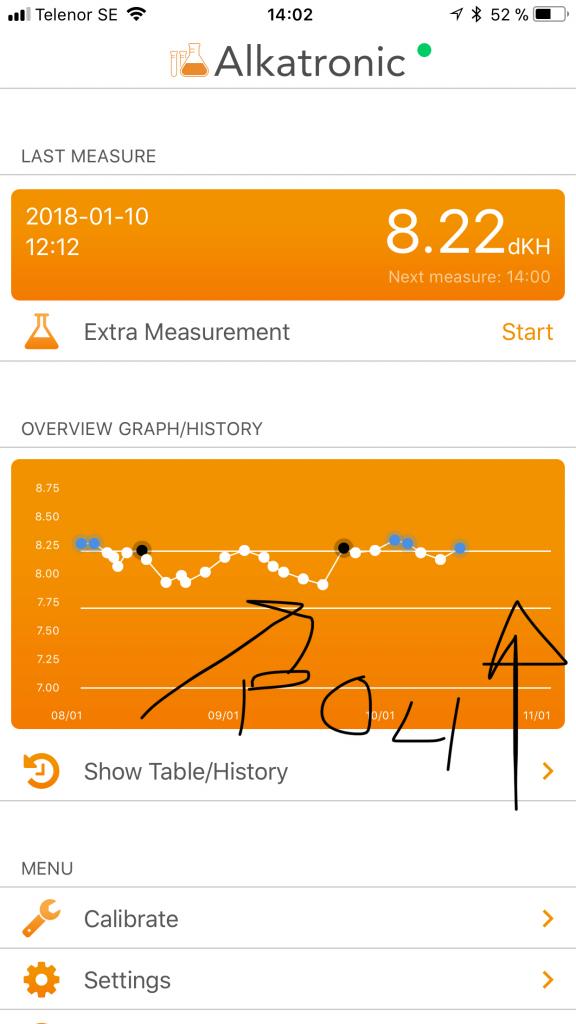
hoppet upp är förresten ett vattenbyte, men sen ligger alltså KH kvar, trots att kalkreaktorn dessutom är avstängd! (det säger de blå punkterna). alltså lägre KH förbrukning än dagen innan. Och skillnaden jag kan mäta är att fosfat steg från cirka strax under 0.1 till det dubbla efter att cyanon dog. Jonas
-
För högt fosfat tror jag hämnar kalkbildning
Vi fortsätter: Kört med chemiclan, KH steg då av orsak jag ej är helt säkert på. Men sen när cyanon dog, så steg fosfat inte oväntat, till 0.2ppm!!!...dagen därpå ser man denna KH kurva, som ej vill gå ner, som den brukar på dan, dvs jag ser samma fenomen igen där jag tolkar det som att den höga fosfaten hämmar kalkbildningen. Vi såg inte detta tidigare då vi ej mätte KH så tätt. Nu ser man. Sen kan vi spekulera i orsaken, men jag tror fortfarande det beror på högt fosfat. Jag ser det nu för andra gången på 2 v. /Jonas
-
Alkatronic Controller
Hej Det fina i kråksången är att i enlighet med Ballings principer som ju baseras på biologiska lagar, så drar ett akvarium Kalcium och Mg i en hyffsat konstant relation i förhållande till vad det drar KH. Därför skall doseringen på en Balling på alla kanaler(Ca, KH, Mg) styras enbart av KH förbrukningen. Det betyder att du behöver aldrig mäta Ca eller Mg för att veta vilken dos du skall ha på dina Ballingkanaler. Så Triton har helt rätt(såklart), det är alltid ALK man styr mot. (Jag mäter personligen Ca o Mg kanske nån gång var tredje månad bara, mest för skoj skull). När du kör Core7 så ställer du akvarievolymen i Alkatronicen under "settings" till: (din sanna volym)/7. Då kommer Alkatronic, och sedermera Dosetronic (Vår kommande 5 kanaliga precisions-doserstation baserat på stegmotorer som kommer även kunna styras och finjusteras av Alkatronic) anpassa dosen utifrån ditt core7-recept. Mvh Jonas
-
Alkatronic Controller
Tack:-) Vi jobbar på den nu:-) Men just denna veckan o nästa ligger all kraft på att få klart tillräckligt många maskiner för första utskeppningen nästa vecka:-) Spännande detta. "Vi" bränner idag tex ett hyffsat stort antal SD-kort, med programvaran. Så mkt jobb alltså, och häftigt med sådan kvantiter. Man går ju inte o köper 3 m slang, utan 300 meter osv:-) Tack för all uppmuntran, och höll ögonen öppna för Android-appen. Den kommer:-)
-
Vitt damm?
Bakterier tror jag. Körde inte du kolkälla? Nopox? Om du kör kolkälla, kan du redovisa vad du nu har i nitrat o fosfat? Tveksam till kolkälla i relativt nystartade o lågbelastade kar. Många kar behöver aldrig kolkälla, det är så att säga inget obligatoriskt för att få fart på bakterierna. Det är mest ämnat till system där man vill pressa ner näringsämnena riktigt lågt för att få färggranna sps koraller, i ett system där man då dessutom tror sig ha brist på kol i jämförelse med nitrat o fosfat. Så typkaret för kolkälla är mer: Ett kar som passerat alla inkörningsfaser, har en del sps som du vill pressa fram färgerna på, och nitrat o fosfat ligger BÅDA för högt, samt någorlunda i kvoten 10-20/1. När bakterier växer pgr av kolkällan så bildas det detta vita ludd/film o lite disighet i vattnet. Allt kommer inte skummas ut med skummaren, så en hel del blir kvar i systemet o dör tillbaka där du minskar på dosen. Därför är det viktigt också att inte bolla med dosen upp o ner, utan idealiskt börja mkt lågt o sen öka långsamt o hamna på en underhållsdos. Det är mkt svårt, och är svårt för alla, även mkt erfarna akvarister;-) Mvh Jonas
-
Akvariekemi och koraller
Tror det är en bra metod att här köra kolkälla så nåde N o P är högt. Jag hade nog helt enkelt bara höjt kolkälledosen lite till. Om det inte funkar hade jag övervägt ett algrefugium. Den kommer ta nitraten bra, och sen kan du kompletera med mer GFO, då alger tar lite mer N än P än vad bakterier gör.
-
För högt fosfat tror jag hämnar kalkbildning
@Lasse, "döma ut" tycker jag är ett missvisande ordval, när man redovisar en iakttagelse, och sedan drar en relevant slutsats baserat på kunskap och erfarenhet. Det är så utveckling o lärdom fungerar. Självklart kan vissa slutsatser eller konsekvenser av en ny upptäckt med tiden tonas ner, och rent av vara fel, men det kan också bli tvärtom. Allt handlar om att hitta de bästa vägarna och sanningen. För att kunna göra det handlar det inte om att skydda eller inte skydda fabrikat. Som du vet handlar detta om business, så det blir naturligtvis vår uppgift som är ekonomiskt oberoende, att påpeka samband vi har indicier på. Jag kallar det kritisk granskning baserat på professionella iakttagelser, kombinerat med beprövad kunskap och erfarenhet. Så när blir något en sanning?. I denna komplexa värd, och till stor del gäller detta inom medicinen också, är många saker omöjliga att föra till 100% bevis pgr av dess multifaktoriella natur. Därför är det av stor vikt att ha ett öppet klimat med högt i tak. Rädslan att aldrig veta något till 100% får ej lägga sordin på att dra slutsater utifrån de vi vet och ser. Vi är inga "duvungar" som diskuterar, och iaktagelserna är inte tagna ur luften. Här har vi på ett ganska sakkunnigt sätt, med dessutom välsignelse av en Dr i kemi(i just detta fall), funnit att vi har starka indicier på att GFO innehåller inte bara GFO. Ett preparat som har som bieffekt en betydande effekt på alkaliniteten på mkt kort tid, (för det har vi visat med i alla fall Rowaphos) är inte ovidkommande. Det är inte att hänga ut någon, det är ren fakta. Jag tycker inte du skall förminska denna "upptäckten" och det resonemang vi för kring det, för det påverkar en av våra viktigaste parametrar på ett rätt betydande sätt. Vi vet dessutom att en överdos av GFO kan ha mkt negativa effekter på koraller. Kanske är det inte alls sänkningen av fosfat utan sänkningen av alkalinitet på kort tid? Där vet vi en hel del, om vad snabb sänkning av alkaliniteten innebär. Detta är en ny infallsvinkel på GFO som jag inte sett mkt skrivet om, som jag inte tycker man skall välja att vifta bort. Beträffande Alu-prep, ja där vet vi ju att Al är inte skadligt upp till en viss nivå, OCH det är dessutom helt känt att prep avger Al, så den jämförelsen känns inte relevant. En parallelldiskussion är aktivt kol, där vissa fabrikat släpper fosfat mer än andra. Det är inte heller att hänga ut ngn, utan ren produkt-research. Sen att företag som tex Triton håller en låg profil beror naturligtvis på att dom också är ett företag med ekonomiska intressen samt juridik som reglerar vad dom får säga. Det har inget med vetenskap att göra. Men här, vi privata aktörer, vi skall skriva och dra precis sådana här slutsatser som vi gör. Exakt så skall vi göra, om vi vill utvecklas. /Jonas
-
Akvariekemi och koraller
Min erfarenhet är att många sps mår dåligt och kan även dö vid nitrat över 50 ppm. Du ligger verkligen och balanserar på en skör tråd. Även fosfat är på tok för högt anser jag. Fosfat skall helst ligga under 0.08 ppm,, och idealiskt 0.04-0.06ppm tycker jag. Nitrat helst ej över 5ppm, men idealiskt mellan 1-5 ppm.
-
Chemiclean
Preparatet är inte godkänt i Sverige för att det saknar innehållsförteckning och om det hade haft en innehållsförteckning hade det inte blivit godkänt för att det innehåller antibiotika.
-
Chemiclean
Hej Troligen är det inget mystiskt alls med chemiclean(sällan något är mystiskt för övrigt) Det innehåller enligt uppgifter jag fått från fler håll (100% ej validerat mel bl.a. från en Dr) antibiotika och närmare bestämt erytromycin. Om det stämmer sysslar dom med ful marknadsföring för de skriver att det inte innehåller ”Erytromycinsuccinat”. Erytromycin är det likväl. Succinat och andra ändelser är bara salter man ”kopplar på” för att styra upptaget i människan magtarmkanalen, var man vill ha upptaget etc. Spelar alltså ingen roll, erytromycin”xx” är lika mkt erytromycin och antibiotika som erytromycinsuccinat. Ful markadsföring isåfall. Detta stämmer bra med preparatets snabba och 100%-iga verkningsmekanism. Stämmer detta (vilket jag inte har anledning att betvivla , infon kommer från Flera källor.), så är vidare rådet på deras förpackning att underhållsbehandla en gång i månaden ett dåligt råd. Sen att det inte skulle störa den normala bakteriefloran som dom påstår, tror jag är inte sant. Detta gör inte behandlingen dålig. Den funkar såklart och jag tror den normala bakteriefloran hämtar sig snabbt. Så jag är inte orolig att använda chemiclean om det sker högst en gång i halvåret kanske. Men bra o veta vad det innehåller och att marknadsföringen är väldigt missledande. Jonas
-
För högt fosfat tror jag hämnar kalkbildning
Sa inte att det blir ett problem med säkerhet, men det skall stå vad saker o ting innehåller. Vi är rätt avancerade användare, och lika väl som vi skickar vårt vatten på ICP, som ett uttryck för nivån vi sköter våra kar på, så skall man veta om tex GFO dränerar alkalinitet, dvs gör något mer än det som är huvudeffekten. Det är självklart på vår nivå tycker jag. Och dessutom, hur vet vi att detta inte kan ha haft betydelse? Det är allmänt känt att en överdos av Rowaphos kan ha skadliga effekter i karet, så det stämmer nog inte att det fungerat "utan kända problem"...kanske problem orsakade inte bara pgr av lågt fosfat? Mvh Jonas
-
Testa aktivt kol för fosfat?
intressant:_-) bra test:-)
-
För högt fosfat tror jag hämnar kalkbildning
det är väl helt vedertaget att det är så. Frågan är väl om det bara är GFO eller om dom smugit in järnklorid för att öka effekten? (Om det nu gör det)....Som jag förstått det kan inte Randy heller förstå hur rent GFO direkt kan sänka alk varvid mina mätningar samt det du sa Lasse talar för att Rowaphos innehåller nåt mer, ja tex järnklorid då. . Då undrar jag vidare om det är därför som Rowahpos är mer effektivt än mkt annat? Och isåfall, om det är det pgr av insmugglandet av denna trojanska häst, känns det halvokej.
-
För högt fosfat tror jag hämnar kalkbildning
ja såklart är det så:-)...jag ville bara tänka i "serie" vad som direkt sker när Fe3+ kommer i kontakt med vatten av pedagogiska skäl, där alltså Fe(OH)3 bildas blixtsnabbt pgr av dess mkt låga löslighet. Det är som du säger bara en teoretisk bild, om vi tar OH joner eller tillför H joner. men det är intressant att det går i tre steg, o slutar upp i Järnoxid, det är enklare(för mig i alla fall) att förstå den slutprodukten om man tänker att det börjar med att ta upp OH. NU börjar det roliga: Vi måste såklart testa flera fabrikat med sk "GFO" o se om motsvarande sker. Jag hävdar fortfarande att min första förklaringsmodell(att KH ej påverkas o pH snarare stiger) är korrekt vid ren GFO. Jag har alltså använt Rowaphos här. Mvh Jonas