All aktivitet
-
Nybörjar kemi.
vet inte vad du vill med den frågan, eller om jag tycker den är relevant. Jag tycker jag förklarat rätt bra varför ditt ph stannar på 9.3, trots ytterligare tillförsel, samt att det inte ett bevis alls på vad det innehöll du tillsatte, utan så det blir så länge du har bufferten kvar, läs HCO3 joner kvar. Och det har du ju vid pH 9.3, till o med riktigt många. vid pH 8.9 så befinner ju sig hälften av jonerna som HCO3 och hälften som CO3, så du ligger ju inom en bra buffertkap med dina 9.3. Sen om du hade tillsatt ytterligare, hade du till slut fått ett plötsligt skutt upp av pH, och DÅ är HCO3 helt slut, och ph går upp till 11-12. Du får tänka syratitrering fast tvärtom. Mvh Jonas PS: Nu säger jag godnatt.....ser visst att detta var en nybörjartråd.....;-)typiskt oss;-)..
-
Nybörjar kemi.
men det är väl sötvatten, dvs obuffrat.. som sagt, rent vatten plus Na2CO3 får ju ph 12 initialt
-
Nybörjar kemi.
nej, men vid pH 9 resp 5.9, så är vattnets buffert som starkast. Du har ju HCO3 joner med som vill dra ner. pKa värdet 8.9 betyder att hela karbonatsystemet vill låsa fast pH värdet där. Det betyder 1) vid pg 5,9 står vattnet bra emot en syra 2) vid pH 8.9 står vattnet bra emot en bas(där HCO3 vill sänka) dvs först när alla HCO3 joner är slut, stiger ph igen. Som en omvänd KH titrering. då får vi en backe rakt upp, med ett ph på 11-12...men då måste du tillföra så mkt Na2CO3 så alla HCO3 joner har gått åt. Så länge dom finns kvar, försöker dom hålla kvar pH kring ska värdet 8.9. Dom lyckas hyfsat i ditt fall. Ditt fall säger ju inge om vad lösningen innehöll för mix, utan endast vad som sker i ditt akvarium. Det enda du vet är att HCO3 jonerna ej är förbrukade eftersom pH stannade kvar på den raka linjen motsvarande pka för CO3.
-
Nybörjar kemi.
pgr av bufferten, ungefär som att pH ligger som ett järnrör kring 5.9 hur mkt syra du än tillsätter (såklart till en viss gräns) pka för CO3 är 8.9, så CO3 buffertkapacitet är enormt bra vid pH runt 9, suverän upp till pH 9.5, där funkar CO3 som en mkt mkt bra pH stabilisator. Därför steg inte ditt ph mer. Faktum är att ditt slutph stämmer hur bra som helst med buffertmaximum för CO3. Dessutom tillförde du ju massor med CO3, så ju mer CO3 du tillförde, desto stadigare stannar pH runt 9. så det är inte alls konstigt.
-
Nybörjar kemi.
Lasse , innan du tar slutgiltigt beslut vilken kurva du tror är viktigast att den är hyffsat rak, så gå upp mot i natten o mät KH..o sen adderar du den infon med den enorma erfarenhet vi har om vad KH svängningar betyder för ett kar. Sen är det upp till var o en. Jag talar alltså inte om absoluta värden av pH, självklart skall det inte va för lågt, det är det ju inte i ditt fall nån nång...utan nu talar vi ju om det dynamiska förloppet, svängningarna. Din regim ger nog en enorm KH topp på natten...vill man det??...såklart vet ingen, men det ör min reflektion
-
Nybörjar kemi.
kan du ange hur mkt lösning du doserade? samt vilket pH du hade innan det skedde, samt din volym på karet. Då kan man räkna ut det förväntade pH värdet OM vi låtsas att lösning var ren Na2CO3 (som jag tror att det är, har som sagt mätt på den).
-
Nybörjar kemi.
klart att det var, men nu talar vi om svängningar- Du vill jämna ut nattens dipp. Det fanns en dipp då med.
-
Nybörjar kemi.
jag skrev fel, spelar ingen roll, mitt argument kvarstår. 9.3 eller 9.6. Samma svar från mig. Vad det exakt stannar beror på massa saker. Du kan såklart inte förvänta dig att det skulle stiga till 12!...du har ju inte rent Na2CO3 lösning i karet för tusan.
-
Nybörjar kemi.
Hur förklara du att core 7 har ett ph på 12? jag vet vad en mix lösning får för pH. Inte 12. jag har gjort dessa olika recepten själv, så jag gissar inte direkt. Ditt huvudargument att ditt ph stannade på 9.6 stämmer inte Lasse. Vad du för för slutpH i ett sådant scenario är mer komplicerat än så. jan kan inte räkna ut det heller på rak arm, men redan 9.6 låter högt, talandes för att lösningen du hällde i hade ett pH på 12. Du har ju en buffert med.
-
Nybörjar kemi.
högre?, okej, 12.1 då...nej, du för läsa mitt senaste inlägg. Du glömmer helt att att kar har en buffertkapacitet. Det stannar på 9.6 oavsett.
-
Nybörjar kemi.
Ja, det finns mätningar på det Lasse. Det finns mer bevis för ur koraller mår dåligt av KH svängningar än pH svängningar. Det senare tror jag inte finns bevis för alls o talar emot den massiva erfarenhet vi akvarister har. Men det är upp till var o en. jag vet vad jag tror på;-)
-
Nybörjar kemi.
det är ju det jag säger...i rent vatten ger Na2CO3 pH 12..och tritons core 7 har ju det pH (läs mitt inlägg igen)....men du doserade ju ner det i ett akvarium...såklart blir det inte pH 12 där. Du doserade väl inte ner 600 liter core 7...dvs bytte ut hela karets vatten mot core 7...eller fattar jag dig fel vad som hände?? har du en lösning med pH 12 som doseras ner aldrig så mkt i 300 liter vatten med urspungspH typ 8, så får du såklart inte ett ph 12...det blir ju vad som helst...9,6 låter väldigt högt, ytterligare talandes för att doseringslösningen hade ett ph på 12, dvs ren Na2CO3. OCH att det så att säga stannar på 9.6 har ju mer med att göra med vilken buffertkapactet du har i karet, än lösningens pH. Jag hävdar att ditt resonemang är inte korrekt.
-
Nybörjar kemi.
En kommentar till: Intressant ide att dosera KH bara på natten, men då prioriterar du alltså ett stabilt pH framför ett stabilt KH....;-)...varför det? pH svängningar förekommer i naturen med över dygnet, men inte KH svängningar. Till detta så vet vi att KH förbrukas betydligt mer på dagen: ungefär 70-80% av KH konsumptionen sker på dagen. Din regim förstärker ytterligare en ojämn KH-dygns-kurva. Jag skulle gissa att ditt KH på natten, som du ej känner till, är minst 0.5-0.7dKH högre än på dagen. Därför borde man göra tvärtom, (om man tror på stabil KH, det behöver du inte hålla med om), att dosera cirka 70% av den totala KH dosen på dagen, o högst 30 % på natten. Jag är helt säker på att det är en viktigare prioritet samt liknar naturen mer att göra så. Smällen man tar är att pH skillnaden blir större över dygnet men vad gör det? Det är ju så i naturen med. De som kör Ca reaktor o ej kan styra tillförseln så snabbt, har tydliga KH kurvor som liknar inversa pH kurvor. Vad är det vi vill?, likna naturen tror jag. Jag har gjort precis tvärt emot som du gör sedan jag fått insikt hur en KH kurva ser ut i ett slutet system. Nu, men hjälp av min doserstation och kontinuerlig KH mätning, kan jag se exakt var jag skall gå in med min KH lösning. Det har lett till ett KH som är som ett streck över dygnet, men pH såklart, som vanlig, en dygnskurva, som ju även i naturen. Men så har jan ett refugium också, så även pH är hyfsat högt på natten skall sägas, för att vara på natten. /Jonas
-
Nybörjar kemi.
Jag menar så här...du överdoserar kraftigt Core 7, men alltså, ren Na2CO3 har ph 12...så de är väl inte konstigt alls att du inte landar på pH 12...du har ju ändå ngr hundra liter vatten med normalt pH samt buffertsystem som jobbar ner...jag ser inte ditt maxpH på 9.6 som ett bevis för att deras blandning är en kombo. När jag gjorde mitt egna recept så provade jag just detta, att mixa in en liten del NaHCO3, inte alls mkt, men ändå behålla faktorn ggr 3.5, och då fick den lösningen ett pH på 9.5...men tritons har ett pH på 12. Det talar emot att core 7 är en mix. Om du får ett lägre pH med tiden i din core 7, tror jag det beror på att den stått i kontakt med luften. Nu mätte jag precis på en core 7 som varit oöppnad, ph 12. Angående ph värdet när HCO3 sänker har jag också provat, så vi har helt enkelt olika resultat. Jag undersökte en period när jag doserade rent HCO3, alltså vanlig balling, och pH sjönk alltid efter HCO3 doseringen, vid alla ursprungsvärdena jag hade i karet (som låg mellan 7.8-8.1). Inte förrän jag gjorde ett vatten med pH 7.7, så kunde jag se att HCO3 tillsättning hade en stigande effekt på pH värdet. Detta stämmer ju bra med teorin också. När jag titrerar nu med min Alkatronic kan jag se samma sak, eftersom jag ser pH värdet i LCD samtidigt som syran tillsätts. Där ser man precis samma sak, att buffertkapaciteten är usel ner till ungefär pH 7, där först börjar HCO3 jonerna arbeta som en bas tydligt. Stämmer bra med titreringskurvan som är planast runt 5.9. Jag har också gjort egna titreringskurvor med så att säga våra moderna marina salter för att hitta dom rätta ändtitreringspunkterna för just våran situation, och den är ngt lägre än litteraturen, dvs 4.2 för HCO3(Fast Randy säger faktiskt också 4.2 så vi är överens). Så den känslan jag då får är att det stämmer rätt bra att HCO3 är en syra vid pH över 7.7. (7.8 kanske). Men jag skall försöka göra om testet, alltså huvudfrågan som tråden egentligen handlar om: vid vilket pH höjer resp sänker HCO3 tillförsel. Men som sagt, Balling har jag ju kört i alla dess former , och jag har varje gång märkt att HCO3 sänker pH vid överraskande redan låga pH. Nu kör jag därför också Na2CO3, eller core 7 då, men en gynnsam effekt på pH värdet förstås:-) /Jonas
-
Nybörjar kemi.
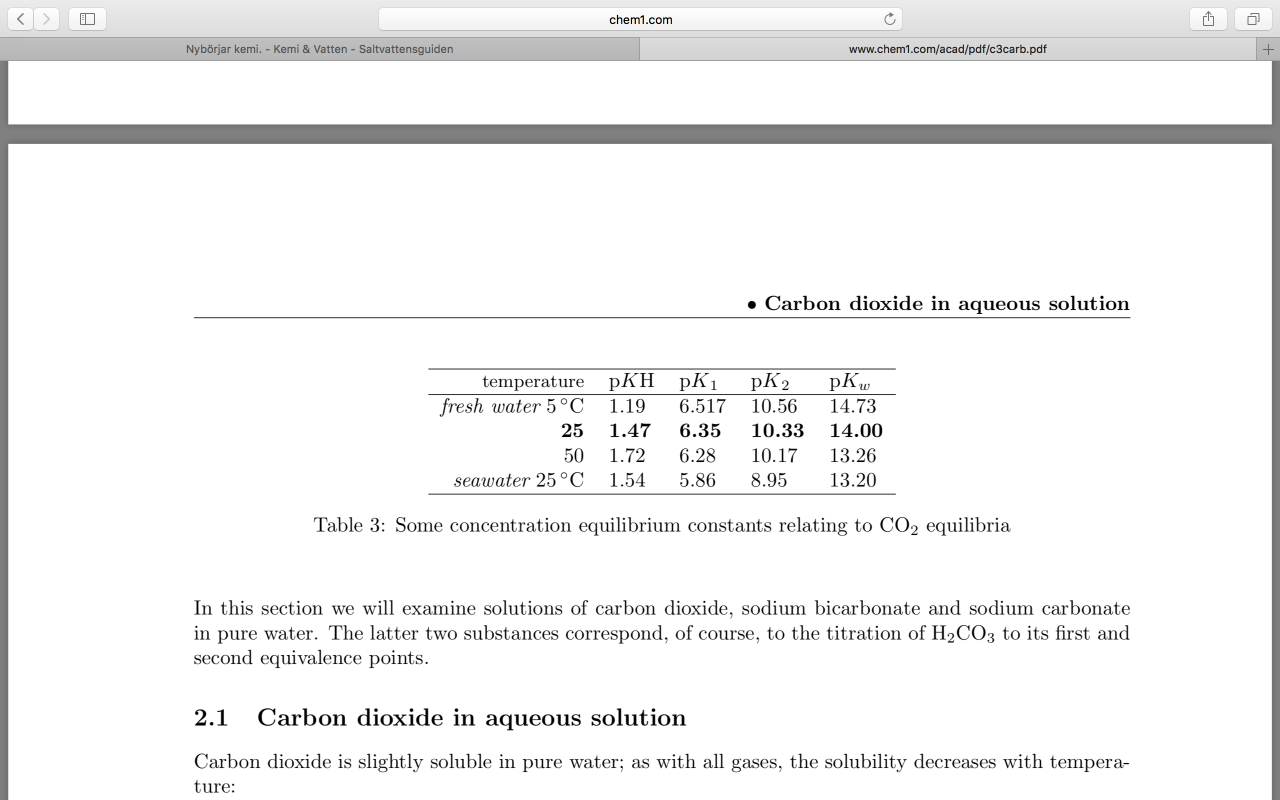
har testat. vi har olika resultat isåfall, o mitt stämmer ju närmare den teoretiska sanningen;-) skall läsa det andra mer noggrant men här har du pka för salt o sött så länge . stämmer perfekt på sötvatten , 8.3.
-
Högt kalcium (Ca)
ingen fara, Ca är inte alls så kritiskt, tål ganska stora toleranser, mellan 350-550 skulle jag påstå är helt ok, även om man såklart siktar på 420. Kör du Balling skall du såklart minska på ca kanalen, men finns ingen anledning till nån mer åtgärd än så:-) Det är KH som är det viktiga;-)... Jonas
-
Nybörjar kemi.
@Lasse, o för intresserade: 1) Ta 2 glas, höj KH i dessa med lika mkt, men i det ena använder du Na2CO3, i det andra NaHCO3...först stiger såklart ph mer i det ena glaset, men dagen därpå efter utjämnad jämnvikt är pH samma i båda glasen!. 2) Sist jag mätte, och mätte nu igen, ger för handen att core 7 KH lösningen har ett pH på 12, talandes för ren Na2CO3. Att ditt ph i karet ej går över 9.6 vid överdosering gäller även vid tillsättning av ren Na2CO3, eftersom det direkt finns utjämnade krafter att dra tillbaka pH värdet, se punkt 1 ovan. 3) Det där med jämnvikt 8-8.3... pka för CO3 i saltvatten är 8.9, och pKa för HCO3 i saltvatten är 5.9. När man skall hitta den punkt vid vilket då HCO3 höjer eller sänker pH så letar man efter den sk ändtitreringspunkten för CO3. Den är medelvärdet av de 2 omkringliggande pka värden, dvs (8.9+5.9)/2=7.4. Det är överaskande lågt, och betyder att vid ph 7.4 är exakt alla CO3 joner slut, uttitrerade. Det betyder att vid pH 7.4 o lägre, så kommer HCO3 helt o hållet att fungera som en bas, och alltså höja pH värdet vid tillsättning. Vid pH över 7.4 kommer HCO3 fungera som en syra, och sänka pH vid tillsättning. Rent bildligt kan man tänka så här: Vid pH 7.4 så ligger nästan alla karbonater i form av HCO3. Just vid denna sk brytpunkt är det så. Titreringskurvor förklarar. Vid pH 7.4 och under 7.4 är det "omöjligt" för en CO3 jon att existera(nästan), vilket betyder att tillförda nya HCO3-joner vid pH <7.4 kan bara göra endera av två saker: 1) antingen ingenting, den största delen gör så vid detta pH, stannar kvar som HCO3 och är oreagerade vid detta ph(därför buffrar HCO3 dåligt vid detta ph) , eller 2) ta upp en vätejon. Nettoeffekten blir därför att HCO3 fungerar som en bas här(om än mkt svag), och att pH stiger. Ju lägre pH man har, desto mer kommer mekanism nr 2 dominera, och den pH höjande effekten av tillförd HCO3 stiger(och HCO3 buffrar bättre o bättre). Men så fort man kommer över pH 7.4, finns det en liten del carbonatjoner i vattnet, varvid tillförda HCO3 joner nu kan göra endera av två saker 1) Ingenting, sammas om ovan, största delen reagerar EJ och blir kvar som HCO3, eller 2) en liten del trots allt går över till CO3, o därmed nettomässigt fungera som en syra. Så rent schematiskt kan man tänka lite bildligt återigen att vid pH 7.4 är HCO3 helt inert, vare sig en syra eller en bas, alltså usel som buffert, och tillför man HCO3 vid exakt detta pH stannar alltså alla tillförda HCO3 joner kvar som HCO3 och inget händer med pH .(nettomässigt). Sen ovan o under detta pH värde(7.4) , handlar det om nettoeffekten, dvs vad vill HCO3 helst göra, avge en H jon eller ta upp. NU är detta ph 7.4 lite i lägsta laget om man gör detta experimentellt skall jag erkänna, och kanske beror det på att vi har inte exakt samma salt i våra akvarium som ett experiment med ren NaCl(och därmed inte exakt samma ska värden). Min erfarenhet är därmed att brytpunkten där NaHCO3 höjer resp sänker pH i saltvatten är vid pH 7.8(kanske 7.7) . Det har jag experimentellt reproducerat flera gånger. Men om man räknar på sötvattens pka, som är högre, då kommer man närmare de värden Lasse anger. Där är pKa för CO3 10.3, och för HCO3 6.4. Då kommer ändtitreringspunkten för CO3 hamna på (10.3+6.4)/2=8.3. Dvs det värde du anger, men det gäller alltså sötvatten. Just därför så har en NaHCO3 lösning detta pH, den är ju baserad på osmosvatten och NaHCO3. Mvh Jonas
-
Nybörjar kemi.
korrekt! Det sista stycket dock en kommentar: Det är likgiltigt ur KH synvinkel om man tillför detta i form av Na2CO3 eller NaHCO3. Man väljer med fördel Na2CO3 som kemikalie om man har bekymmer med lågt pH, annars NaHCO3. För att gör en lösning som innehåller lika mkt KH och är av sk standardkonc, tar man 81gr per liter om man väljer NaHCO3, och 51gr per liter om man väljer Na2CO3. Då får man samma KH innehåll i dessa. Mvh Jonas
-
Hjälp med beräkning av salthalt
Det enklaste är ju bara att slänga ner lite salt i ATON, o sen mäta en gång om dagen o när du nått ditt målvärde kör du med rent RO vatten igen, o har du inte mått målvärdet slänger du i salt i nästa RO "blandning" igen. Om man så att säga inte måste höja snabbt utan bara vill finlira är ju detta enklast o säkrast med. /J
-
tempöverkompenserar saliniteten?
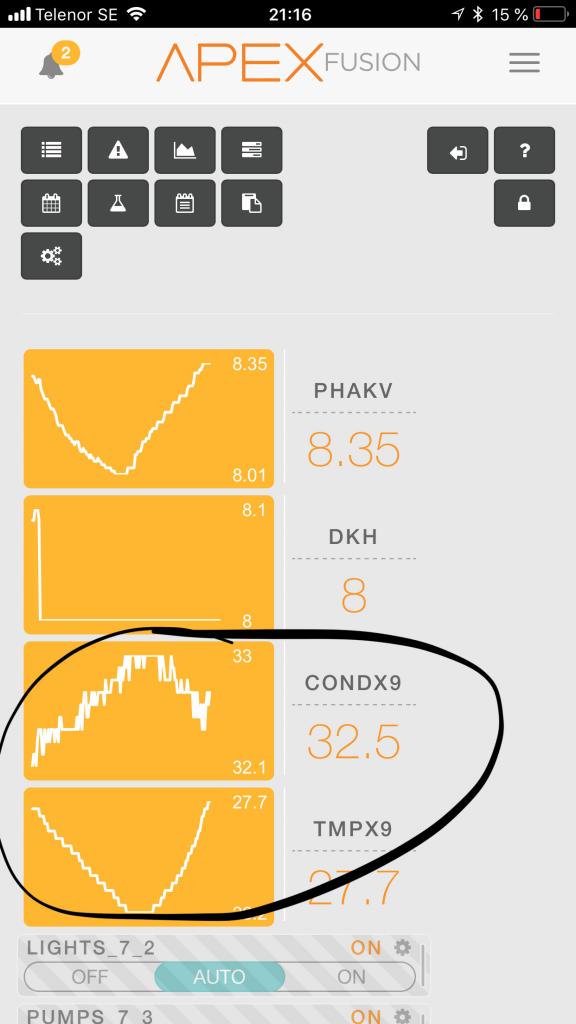
Så nu har jag testat mig fram o funnit att apex temp kompensering för salinitetsproben, om man följer rekommendationen 2.1-2.3%, kraftigt överkompenserar i mitt vatten. Det är nog inte otroligt att det gäller fler, då jag knappast har en jätteannorlunda jonsammansättning på mitt salt. Så efter att ha sänkt tempkompensationen till 1.3%!!!!!!!!, så förblir kurvan rak trots tempvariation. Så testa det om ni upplever samma som jag gjorde, att tempkompensationen överkompenserade. Märkligt måste medges, för 2.0-2.1 är ju det som skall gälla vid nacl dominerat vatten. Men med 1.3% funkar det i alla fall
-
tempöverkompenserar saliniteten?
okej, helt klart bättre algoritm där då
-
tempöverkompenserar saliniteten?
Har köpt en sal probe till apex. Kör naturligtvis temp komp, annars blir det ju fel då den mäter konduktivitet. Men det verkar som den överkompenserar...dvs när tempen går upp går "sal" ner...utan tempkomp skall dessa följas åt, med perfekt temp komp skall kurvan va rak oavsett temp, o med övertempkomp blir det som här. Jag har faktorn 2.0...det sägs att det skall va mellan 2.0-2.3....så 2.0 borde funka men den överkompensera ju fortfarande!?....skall sänka faktorn till 1.9% så får vi se. Input? @Lasse, hur har du faktorn ställd på din ghl? Jonas Roman
-
Borats bidrag till total alkalinitet
@Bygert, vi vet ju redan det, eftersom vi har ett någorlunda likt vatten som NSV, dvs att vår totala alkalinitet, precis som i naturen, utgörs till 95% av karbonatalkaliniteten. Och vi vet alltså att ungefär 3-5% av den totala alkaliniteten består av boratalkalinitet,och vi vet att det är ju därför som ett saltvatten står emot ph svängningar rätt dåligt kring pH 8, för att vår dominerande alkalinitetsbidragare, alltså vätekarbonat, jobbar dåligt som buffert just där. Det är ju inget problem, naturen är ju sån. Det där med ner till 4...vi är inte intresserade av hur det svänger där nere, vi går ju dit ner för att få med all alkalinitet för att få ett korrekt värde. Vi måste ju mäta på samma sätt. Att tex stanna på ph 5 ger ingen värdefull info, för du har där en del kvar av karbonatalkaliniteten, så ett värde där säger ingenting om nånting. Antingen ända fram till ändtitreringspunkten eller inget alls så att säga. Ser heller ingen anledning att selektivt ta fram boratalkaliniteten. Den vet vi genom ett ICP test. Man får dess halt, o med hjälp av pka o aktuellt ph kan man räkna ut dess bidrag om man nu vill det. Det var egentligen det mitt inlägg handlade om, och borat står då alltså för ungefär 0.2-0.3dKh av den totala, och karbonaterna för resten. Sen då, varför just 4.2 som ändtitreringspunkt? Jo, i sötvatten ligger den på 4.9-5.0 tror jag. Den är alltså mkt lägre i saltvatten, och det beror på att syrakonstanten, pka, för HCO3, är lägre i saltvatten, dvs i saltvattnet ligger hela bufertkedjan o trycker lite mer åt höger, och vi behöver alltså därför mer vätejoner för att få bort all karbonater till CO2. Stannar man tidigare kommer man få ett för lågt värde som inte är lika med total alkalinitet. Du kan inte styra titreringen till att få fram halten av bara ett ämne för andra åker med på köpet. Där får vi istället anlita ICP:-) Jonas
-
Borats bidrag till total alkalinitet
ja det var smart, det borde ju funka:-)
-
Borats bidrag till total alkalinitet
Sen vill jag upplysa om en sak till: Om man får ett KH värde med i ett ICP test så är det ALDRIG mätt med ICP. Det går inte för alkalinitet är inte EN jon utan summan av flera olika med samma egenskaper, att kunna ta upp vätejoner. Att tex ATI har den tjänsten är bara en tjänst. Dom titrerar fram era KH värden precis som vi gör med salifert, red sea, hanna, alkatronic etc etc. SÅ: Jämför aldrig en titeringsmetod med en annan! Dom kan ju ha en helt annan ändtitreringspunkt och därmed få ett annat värde. "KH" mätningar skall överhuvudtaget inte jämföras så mkt mellan två olika metoder, utan mer inom sin egen metod eftersom man kan just ha olika ändtitreringspunkter, SAMT att värdet i sig är mindre viktigt, utan det är precisionen. Jag skulles säga att det utan vidare kan diffa 0.3-0.5 dKH mellan olika metoder utan att ngn gör fel. Man väljer hur man vill mäta helt enkelt. Tänk på detta:-) Jag vet av erfarenhet, och det kan va till hjälp för er, att ATI´s KH värden ligger generellt sett lägre än om du mäter själv. Både du o ATI mäter rätt, ni har bara olika ändtitreringspunkter. Så så länge värdena är inom 0.5 diff, så är troligen båda helt rätt. Så återigen, man jämfört bäst med sig själv. /Jonas