All aktivitet
-
CO2-tvätt
Här ser msn hur städerskorna kom in o huset kl 11:45:-) co2 mätning via telefon är ett bra inbrottslarm:-)
-
CO2-tvätt
Jag har bara köpt "halvbilligt" på Dräger men dey finns billigare om man letar:-) tror inte det finns en nackdel i sig att oh varierar lite, det gör den ju i naturen osv:-) dvs magnetventil osv låter i mina öron lite overkill. Jag har å andra sidan lågt jämnt så jag behöver köra med den 24/7. Då pendlar mitt pH mellan 7.95-8.12 om KH ligger runt 7.7.
-
Dax att logga CO2 i rummet
- Dax att logga CO2 i rummet
på lördag kommer mina syskon med ngr barn...om CO2 går över 1000ppm får dom gå hem, alternativt ta på sig masker med kalciumhydroxidgranulat....:-)- Polsk salttest
- Dax att logga CO2 i rummet
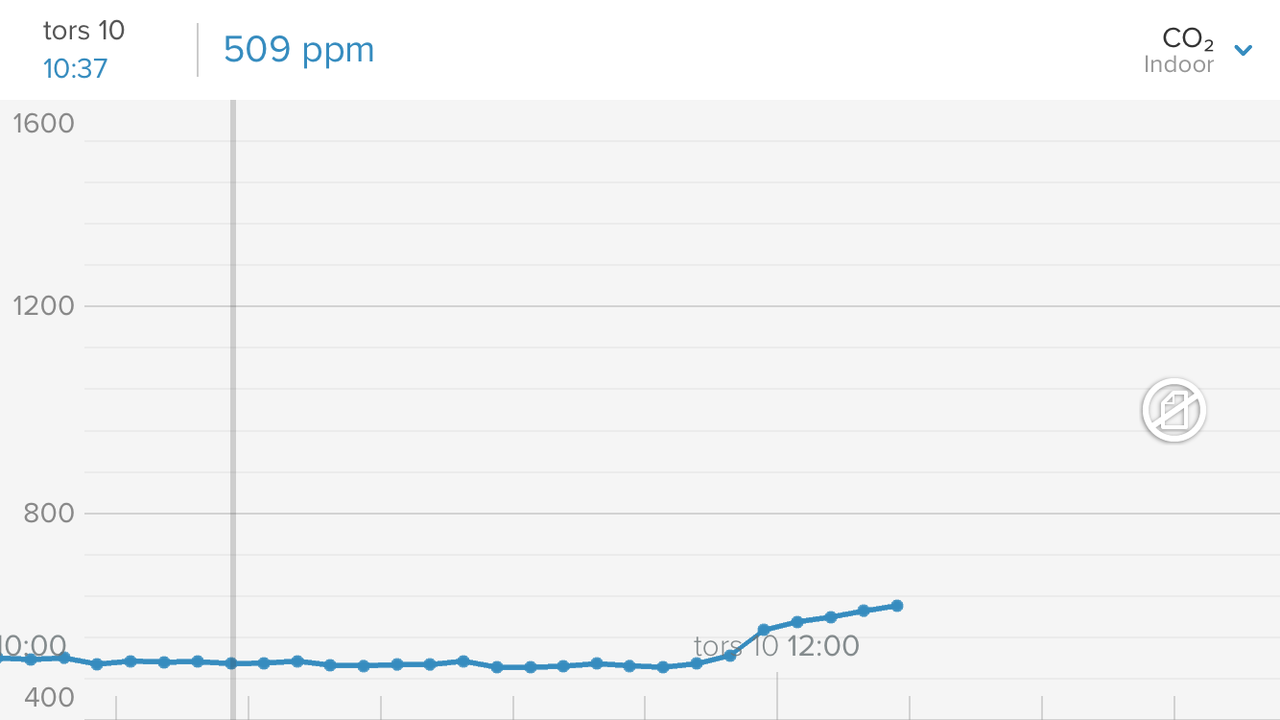
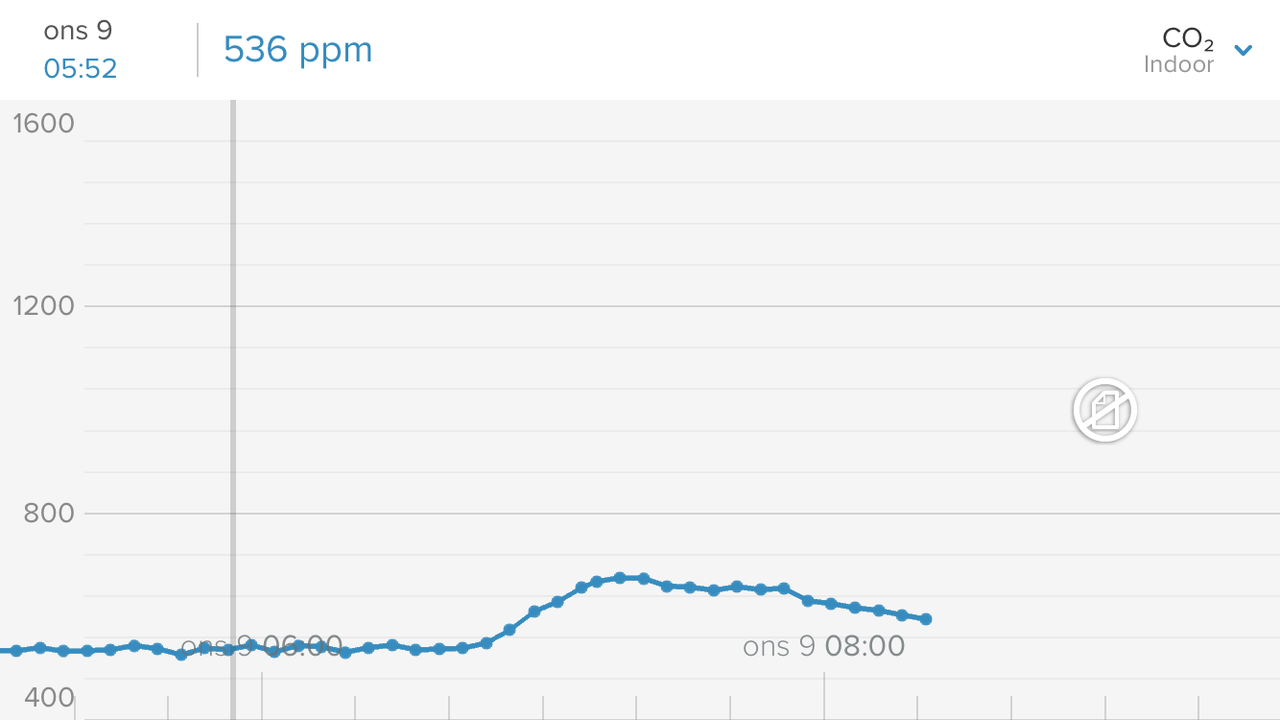
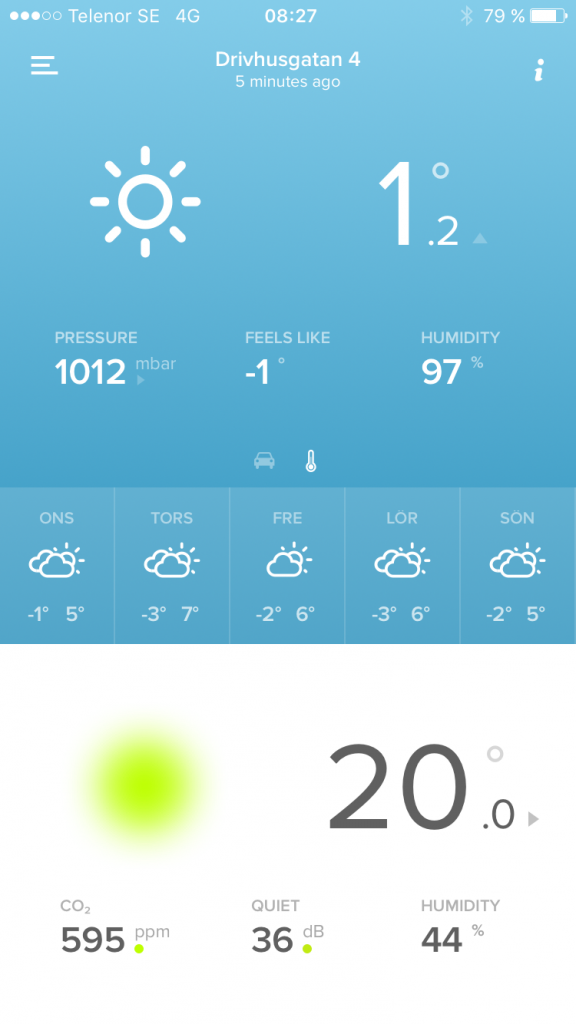
Skall mäta i sumprummet sen. För min del är i o för sig det värdet minst intressant för den luften går via CO2-tvätt till skummaren, och resterande vattenyta där är så liten så den betyder nog inte så mkt för CO2-tillförsel till karet. men jag skall såklart mäta ändå, med o utan stängd dörr osv. I huset ser jag nu att min CO2-nivå när huset är tomt en hel dag ligger på 521 ppmCO2.- Dax att logga CO2 i rummet
@Lasse, länk se ovan.- Dax att logga CO2 i rummet
Resultat: När jag o min son sover på andra våningen ligger co2 runt 530ppm. Så fort vi vaknat men ännu inte gått ner steg det lite. Häftigt! sen när vi gick ner o åt frukost, vara två personer, låg aktivitet, steg det till 600 nåt. Sen gick vi hemifrpn o direkt sjönk tillbaks till 570. Skall bli spännande att se lägsta nivån dvs framåt dan med folktomt hus. Känns redan som att jag/man har högre halter än vad man tror. Stärker indikationen ytterligare att köra CO2-tvätt.- Analys av olika salter som finns på marknaden
Du har inte förstört tråden @Lasse, det vet du ju. Det är ju detta vi är här för, att delge varandra olika syn på saker. Uppskattar detta. Sluta sura nu mina herrar;-)- Analys av olika salter som finns på marknaden
Tycker vare sig @Lasse eller @Edlund skall lämna tråden eller sluta presentera resultat o åsikter. Att vi har olika syn på detta behöver inte innebära att vi inte skall fortsätta diskussionen. Då hade inte många trådar blivit långa här;-)... jag har min uppfattning och känner mig rätt trygg med den med så många mätningar jag har i ryggen men på ett plan håller med Lasse i att vara kritisk. Hade jag bara haft en ellee två mätningar i ryggen skulle jag inte va så säker men nu har jag 14. Lasse, har du lekt med tanken: utifrån det vi skrivit här..skulle du idag gå o köpa AF saltet? Även om du rent matematisk visar på avsaknad av signifikans är jag nyfiken på om du inte också nånstans i bakhuvet när vi inte hör dig efter allt detta skulle avstå AF saltet? En samvetsfråga. ;-)- Dax att logga CO2 i rummet
- Analys av olika salter som finns på marknaden
Jag har lekt med tanken och kommer va ärlig med resultaten från red sea. Men Lasse, jag har sagt tydligt att jag tror, och att signifikans saknas osv. Så jag tycker med dom förbehållen man har rätt att uttrycka sin tro även om det saknas starka statistiska samband. Var o en får själv värdera och behöver inte kopiera min eller din syn. Detta är ett forum, ej en vetenskaplig rapport. I en sådan hade jag naturligtvis uttryckt mig mkt mer "korrekt" o försiktigt.- Analys av olika salter som finns på marknaden
Skälet var detta: jag var kritisk mot AF saltet innan jag ens hade mätt för jag gillade inte konceptet med kolkälla samt att det var helt syntetiskt. Då sa någon" man skall inte säga att maten är äcklig innan man smakat på den". Jag är inte feg o ville ha bevis eller motbevis för min tes o därför testade jag det:-). Kostade sen på mig två tritonmätningar. Resultatet räckte för att stärka min tro, oavsett signifikans eller ej.- CO2-tvätt
Uppdatering: Mina 1 liter "granulat" räcker nog 2.5 veckor. Nu har det gått 2, och finns kvar en ofärgad strimma längst ner. Jag märker ingen sänkning av pH, och det stämmer bra med att mediat verkar 100% ända in i kaklet, o sen när det är mättat(allt ha blivit CaCO3) slutar tvärt. Snart kommer mitt media på posten, det innehåller ingen färgreagens men det gör inget för nu har jag testat med min skummare och min inomhusluft, hur fort det mättas. Tydlig ökning av åtgången på kalcium/KH...reaktorn jobbar för fulla hästar med 45 i KH på utvattnet, med 2 liter i timman, samt driftsid 12 timmar per dygn, och ÄNDÅ håller jag "bara" ett KH på knappt 7.7. Jag ser 20-30 nya skott på min enzman, samt överhuvudtaget ett friskare kar(subjektivt men så tror jag att jag ser). En sak är säker...detta är ngt jag aldrig kommer sluta med. Skulle bara gjort det tidigare.- Analys av olika salter som finns på marknaden
Med det sagt vill jag förtydliga:Det finns lika mkt en fara i att nonchalera mätresultat och vifta bort dom som felaktiga för att dom inte passar det man vill se, som att ha en övertro på dom. Tritonlab uppvisar den troligen högsta noggrannheten vi idag kan enkelt komma över. Med så många mätningar jag har i ryggen tycker jag resultaten prickas in inom rimlighetsgränsen varenda gång. Vore metoden osäker hade jag märkt det vid så här många mätningar, men när jag tittar tillbaka på mina 14-15 ark, så ligger allt oerhört väl samlat. Det får inte bli en masspsykos här att alla så fort ett resultat avviker, viftar bort det. Skall man träffa rätt oftare än fel är jag helt övertygad om att grundinställningen skall vara att lita på de siffor man får. Det kan bli fel, JA, men jag tror det blir oftare fel beslut om vi utgår ifrån att värdena är felaktiga. Kan ju nämna nu tex att mitt jod-värde efter en veckas dosering med egen jodlösning stämmer ruggigt bra med uppmätta resultat. Sen att resten av värdena ligger väldigt väl samlade utan en enda gång en "outsiders" säger en del om metodens höga accuracy. Jag gissar att jag är en av de som mätt mest med triton här, så mina tankar om detta är inte helt taget ur luften.- Analys av olika salter som finns på marknaden
Håller med dig om att i grunden vara kritisk men man får inte heller bli så kritisk så msn missar. Jag har 14 mätningar. 13 är normala. 1 är avvikande. Nu ånyo 3-4 mätningar med det gamla saltet igen. Ånyo normala värden. Jag gör på samma sätt varje gång. Skulle jag blunda för ett liknande samband i mitt jobb hade jag vid det här laget fyllt minst en kyrkogård;-) Har vi inställningen att vi inte kan lita på mätvärden nånsin är det bättre att inte mäta alls isåfall.- buffertförmåga
Den föreläsningen missade jag. Är en apelsin orange så är den det även om åhöraren är färgblind.- Kemiquiz 27/2
Äntligen lite medhåll!:-) precis så.- Kemiquiz 7 mars
OBS: Häng inte upp er på utgångs-pH't på 8.1. Det kan möjligen vara 8.2 vid jämnvikt med luftens 400ppm CO2 samt kh 8. Strunt i det, det är skillnaden som är intressant och som frågan avser och den är samma oavsett utgångsvärdet. Svar: pH stiger till ungefär pH 8.25. Förklaring: För den som inte har sömnproblem kan man läsa fetstilen direkt. Den som famlar i mörkret efter ett bra sedativum kan läsa hela min förklaring;-) Den relativa mängden av gaser inkl koldioxid förstås, är densamma oavsett lufttryck. Luften innehåller 0.04% CO2. Vid 0 meter över havet där vi har 1 atm i lufttryck är således partialtrycket av CO2 0.0004Atm. Alltså 1 Atm x 0.04%. Om vi har jämnvikt mellan luft o vatten(vilket vi antar i frågan) så är vattnets CO2 halt, CO2(aq) som vanligt enbart styrt av just luftens halt av CO2 enligt formeln CO2(aq)=PCO2 x K K är Henrys konstant för CO2. Den är som en konstant skall va, konstant. Olika för söt o saltvatten o temp men dessa parametrar är samma. Sambandet sedan mellan pH o CO2(aq) är i princip linjärt. I alla fall i de pH områden vi nu rör oss inom. För den som vill veta exakt kan man härleda ut CO2(aq) ur karbonatbuffertkedjan och bryta ut H jonerna som en funktion av CO2(aq). Jag besparar er den formeln men plottar man i den in aktuella CO2 värden vid given alkalinitet får man en pH/CO2- kurva som är hyffsat linjär. Det betyder att om vi tex dubblar atmosfärens CO2 halt(då dubblas också CO2(aq) och H2CO3), så dubblar vi antalet H-joner i vattnet. För varje tusen meter sjunker lufttrycket med ungefär 10%. (Lite förenklat). Så på 3000m har vi en CO2-halt uttryckt i atm som är 30%lägre, (dvs ungefär 0.0004x0.7=0.00028atmCO2. ) H-jons halten på alptoppen sjunker alltså med 30% dvs H -jonshalten på alptoppen =H-Jons halten på marknivå X 0.7. pH är -lg(H) lg 0.7 =0.15 Vi hade pH 8.1 från början dvs pH stiger till 8.1+0.15=8.25 Att jag hade med alkaliniteten 8 i frågan är helt ovidkommande och bara för att förvilla lite;-). Alkalinitet är nämligen oförändrad när CO2 ändras så den är även på alptoppen 8. Alkaliniteten påverkar förvisso att det blir just pH 8.1 vid markvärdet. Med 0 i alkalinitet (som exempel) får man ett pH i saltvatten som är i jämnvikt med luft på cirka pH 4.3. (Sötvatten 5.6).- Kemiquiz 27/2
Nej Bygert jag är ledsen du har ej fattat mig rätt. Löst CO2(aq) är fastlåst, konstant, oberoende av pH, VID JÄMNVIKT med luft o vatten. Jag kan inte förklara bättre, mitt fel att jag misslyckas med min pedagogik. Du tänker rätt om du talar om ett system innan jämnvikt (vilket är fallet i tex ett akvarium). Men det du skriver är inte rätt vid jämvikt o det är jämvikt jag hela tiden pratar om. Du får fundera på detta för så här är det faktiskt.- Mitt 650 liters sps
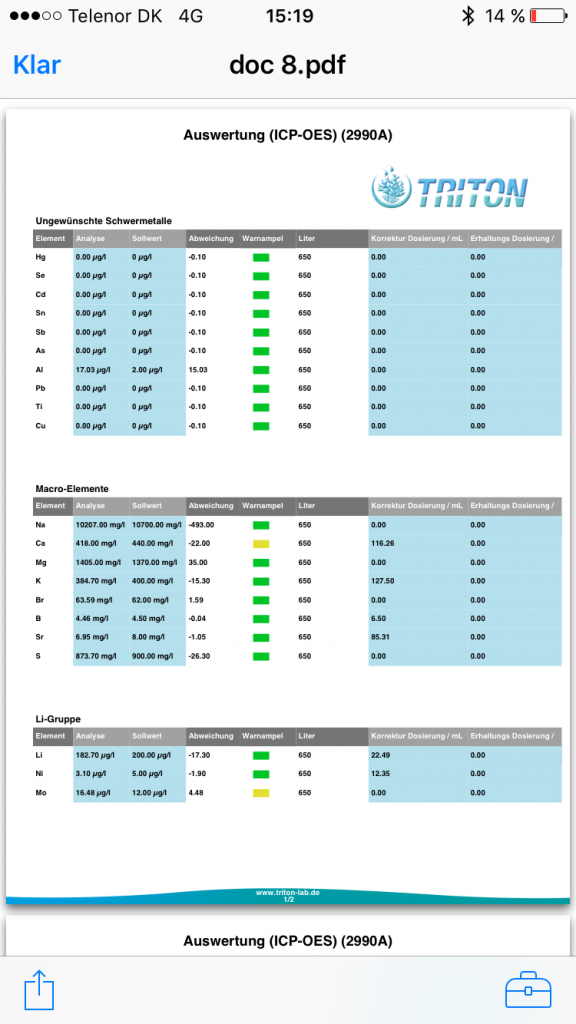
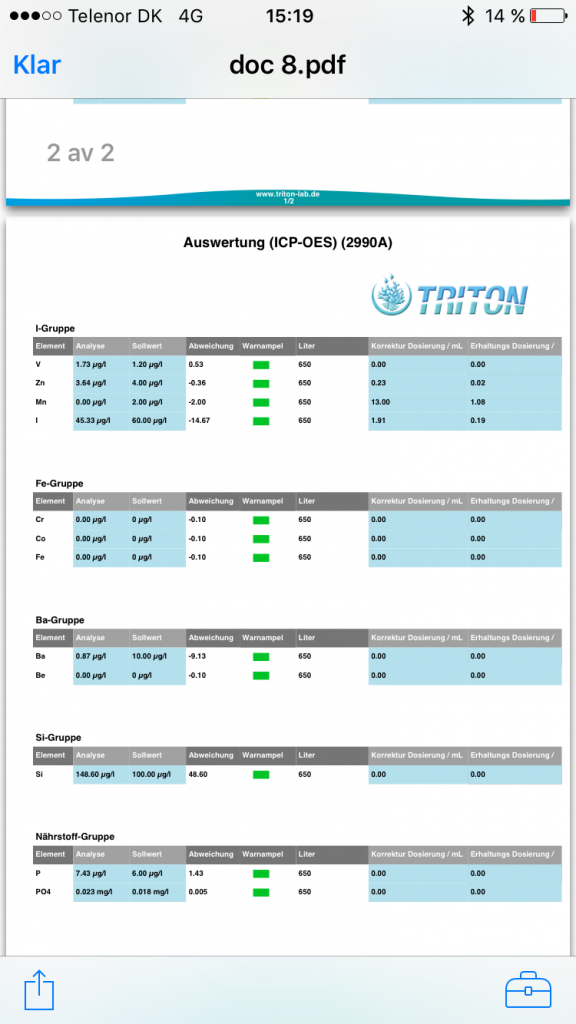
Färska värden från triton lab igen: Börjat tillsätta jod. Innan hade jag ett konstant värde runt 20ppb om jag aldrig tillsatte. (Legat där i 12-13 mätningar i princip) Började tillsätta jod med egen blandad lösning med pulver jag fått av stig. @stigigemla, tusen tack än en gång för din vänlighet. Tillsätter 5 ml per dag till mina 600 liter. Lösningen är på 1mg/ml. Färsk analys från triton efter en veckas daglig dosering. Nöjd. Saltet i "botten" är sedan start red seacoral PRO. Vid endast ett tillfälle har jag haft en del avvikelser som vi diskuterat i en annan tråd efter tillfälligt byte till annat salt. Signifikans eller ej och med all respekt för uträkningar hit o dit, så har jag efter sådana här fina värden på alla mätningar(13st) utom en ett stort förtroende för detta salt. Jag skulle nog va ganska korkad om jag trodde något annat (fast en del anser jag är korkad för att jag drar dessa slutsater.;-)).. nåväl, here is the result. Känns som joddosering är lagom.- Dax att logga CO2 i rummet
Oki;-) ja är det som i ditt fall busenkelt så är det förstås bara en ytterligare fördel:-)- Dax att logga CO2 i rummet
Att ta uteluft till co2-tvätten är bara en ekonomisk fråga. Du kanske sparar 20 spänn i månaden på det;-) men visst kan du göra det. @Lasse, metaforen att köra en Tessla är en smula orättvis...vi pratar om 100 spänn i månaden för att få en optimal lösning vars tekniska komplexitet är en petflaska och en luftslang;-)...- Kemiquiz 7 mars
Vi har ett saltvatten med ett kh på 8 samt ett vatten som är i fullständig jämnvikt med luften. PH 8.1. Luftens halt av co2 är 0.04%. Vi åker nu med vattnet upp på en alptopp till 3000 meters höjd. Inväntar ny jämnvikt mellan luft o vatten. Vad händer med PH värdet? och om det ändras, hur mkt ungefär? vi förutsätter ett normalt lufttryck vid 0 m över havet på 1 atm.- Dax att logga CO2 i rummet
Jag måste upprepa mig: Jag tycker ni som vill dra luftslangar hit o dit går knappt halva vägen till mål;-)... Det går att köpa granulat som tvättar luften helt fri från co2 för 500kr/10kg. Har man en stor skummare som drar 1000l/luft per timma samt räknar med 600ppm co2 i luften (högre i vissa fall som under en instängd sump osv) så räcker 1 liter granulat i 3 veckor uppskattar jag det till utifrån det försöka jag själv nu genomför som är inne på andra veckan. (Mediat är ej mättat än). Eftersom det är som Lasse säger lättare att vädra ut co2 om skillnaden är större mellan co2(aq) och Pco2 finns all anledningen att förse skummaren med luft som innehåller 0ppmCO2 snarare än 400ppm oavsett övriga halter. Det är ju ändå ett visst "meck" med att förse skummaren med utomhusluft, men då ändå knappt komma halva vägen. Räknar jag högt så är kostnaden i mitt fall per månad för komplett CO2-tvätt 100kr. - Dax att logga CO2 i rummet