All Aktivitet
- Senaste timmen
-
Producerar eller konsumerar ett korallrev koldioxid?
Det är också skåpmat att om pH går över jämviktspunkten vid fotosyntes så har inte den egenproducerande koldioxiden (mineraliseringen av organiskt material som vid sidan av koldioxid också tillför organiskt P och N) räckt till för fotosyntesen. Den har delvis lämnat systemet och gått ut i luften medans all oorganisk P och det mesta av det oorganiska N stannat kvar. Om pH inte går över jämviktspunkten även vid full fotosyntes så räcker den mineraliserade organiska kolet till för att uppehålla fotosyntesen. Detta innebär att om fotosyntesen driver upp pH över 7.95 vid CO2 i luften på 800 ppm så räcker inte det internt producerade CO2 till att täcka fotosyntesens behov på systemnivå. Allt har inte lagrats i vattnet vid pH:n under 7.95 utan lämnat systemet på grund av obalansen mellan innehållet i vattnet och luften medans de andra två näringsämnena som också har mineraliserats från organiskt material i stort sett stannat kvar. MVH Lasse
- Idag
-
Producerar eller konsumerar ett korallrev koldioxid?
För mig blir frågan inte så komplex, jag mest skriver om i vilken riktning CO2 åker, oavsett var den kommer ifrån. Givetvis bildas CO2 i karet, allt som cellandas, och givetvis konsumeras en del av detta i karet ( o behöver ej andas ut), allt som fotosyntetiserar. Kanske inte alla förstår vad vi pratar om när vi pratar om "jämnviktspH". Du gör det såklart men låt mig förklara för alla hur jag ser på det: 1) Luften har ett visst CO2 värde, inte lika varierande som vattnets. 2) vattnet har ett visst och ganska varierande CO2 värde på grund av fotosyntes o cellandning. 3) Beroende på det aktuella CO2 värdet i vattnet kontra luftens, så andas karet ut CO2 eller tar upp CO2 från luften. 4) Vid det sk jämnviktspH´t vare sig andas karet ut CO2 eller tar upp. Jämnvikt råder mellan CO2luft/CO2 vatten. Det endast en kort tid, sen blir det ojämnvikt igen och CO2 rör sig över vatten/luft interfacet i ngn riktning. Är pH över jämnviktspH rör sig CO2 från luft till vatten. Är pH under jämnviktspH rör sig CO2 från vatten till luft. 5) och dessa sk jämnviktspH är ungefär: CO2 luft 400 ppm=jämnviktspH 8.2 CO2 luft 800 ppm=jämnviktspH 7.9 Eftersom det är ganska vanligt med CO2 800 ppm inomhus, samt rätt vanligt med pH över 7.9, betyder det att det rätt ofta kommer innebära att ökad cirkulation, ytrörelse, ger ett lägre pH. Att pH då överhuvudtaget någon gång går över 7.9 beror ju på fotosyntesen (tack o lov). Räcker inte den till (nattetid men ibland dagtid) får man ta till utomhusluft till skummare eller CO2 absorber. Som sagt, detta är skåpmat, det jag egentligen vill med tråden var detta att reven bildar mer CO2 än dom tar upp. Inte alla rev men en del, enligt forskarna. länkar kommer /Jonas
-
Producerar eller konsumerar ett korallrev koldioxid?
absolut, postar nedan om en stund
-
Producerar eller konsumerar ett korallrev koldioxid?
Men kontentan är att om pH någon gång under dygnet kommer upp över jämnviktspunkten så har karet förlorat CO2 som har mineraliserat från "införd" organisk kol. Kommer det inte upp över jämnviktspunkten så har den internt producerade koldioxiden i en varierande mängd bara recirkulerats in i ny biologiskt material med hjälp av fotosyntes. Skulle vara väldigt intressant att veta dina källor för påståendet att MVH Lasse
-
Mastertronic Essential
MTE ger värdena i mg/l
-
Mastertronic Essential
exakt så skall man göra som du gjort. nej det är inte steppern. Se mitt svar ovan:-) Mg behöver kal om lite oftare. jag jobbar lite med företaget som gör den reagensen och skall se om vi kan få den att slippa kalibreras om så ofta. Du har helt rätt i dina iaktagelser:-)
-
Mäta NO3, PO4 med olika metoder
Har pratat om detta tidigare. Skickar man iväg ett prov till ICP, sp är den metoden strålande bra på att mäta atomer (ja, det är ju det den gör), och en jon kan aldrig liksom försvinna, så provet är okänsligt för tid. MEN, molekyler kan ändras, och molekyler mäts inte med ICP. Från många ICP lab får vi som bonus idag även KH, Nitrat och PO4. Kom då ihåg, dessa mäts på samma sätt som du gör hemma, med fotometri. PO4: Gällande po4 från icp så mäter man först P med ICP, alltså atomer, sen utgår man ifrån att allt kommer från PO4 och räknar ut PO4 värdet. Dvs P värdet ggr 3 ungefär. Detta stämmer aldrig helt exakt, utan blir teoretiskt alltid lite falskt högt, eftersom ett biologiskt vatten innehåller organiska ämnen också, som kommer inkluderas i P värdet. Det hjälper lite, men INTE helt att filtrera vattnet, för lösliga organiska molekyler filtreras inte bort. Så där har vi svagheten med kalkylerat PO4 från ICP. Tänk, i viss mån alltid lite falskt högt i ngn utsträckning. Enda rätta sättet är att mäta sann PO4, med reagenser och fotometri. Problemet då är att NU kan provet ändras över tid, för sann PO4 kan förbrukas i vattnet i väntan på mätning. Nitrat: Här kan man inte mäta N o sen bara kalkylera (ggr4) och få nitrat. Det skulle bli ett ännu större fel än när man kalkylerar Po4. Så här är det reagenser o fotometri (tror oceamo mäter med jonkromatografi=mkt exakt). Så här får vi sann nitrat, men även här kan värdet ändras med tid, då nitrat kan förbrukas i vattnet. KH: ja, det vet ni ju, mäts med syratitrering. Kan också ändras, oftast sjunker lite, då processer i vattnet kan skapa syror i väntan på mätning. Så gällande NO3, PO4, KH, det KAN bli rätt med distansmätning, men du kan aldrig va helt säker. Sammanfattning rörande distansmätning: "ICP PO4"=kan bli falskt högt pgr av organiska ämnen. "Fotometri PO4"=kan bli falskt lågt på grund av konsumption "Fotometri NO3 "=kan bli falskt lågt på grund av konsumption" "Alk titrering"=kan bli falskt lågt på grund av syrabildning Hur stora felen blir varierar. Mer organiskt i vattnet=mera fel. Hjälper inte helt att filtrera, tar bara bort partiklar, men det finns lösta föreningar också. ICP laben är bäst på atomer. Det andra är färskvara. Så här såg mina egna mätningar ut som kom igår. Se bild. Stämmer bra med teorin bakom pros and cons. (vattnet som skickades iväg var filtrerat) I mina tester ser jag alltid denna trend som bilden visar. Dock så är felen ganska små i mitt fall men dom finns där. Vid högre värden på PO4 och NO3 blir förmodligen deviationerna större. Skall nämnas att hemmamätningen är kalibrerad mot referensvätskor innan mätning utfördes. /Jonas
-
Producerar eller konsumerar ett korallrev koldioxid?
Ja, 440 eller 400, det är oviktigt, principen är densamma och våra jämnviktspH stämmer båda det vi skriver. Jag räknar i huvudet. 10^0.3 =2. Med det menas att om du ändrar ett värde på en logaritmisk skala med 0.3 (som pH är) så är det en dubbling/halvering. Dvs om du dubblar CO2 halten i karet, så dubblar du H+ koncentrationen. En dubbling av H+ jonerna ger en ph sänkning på lg2=0.3 pH Givetvis producerar karet CO2, har inte sagt nåt annat, men på grund av luftens höga CO2 halt blir det svårare för karet att göra sig av med det (om det ens blir aktuellt då vi måste komma över luftens CO2 för att jämnvikten skall gå ditåt). Eventuell utandning går långsammare på grund av högt CO2 tryck från luften. Inget nytt under solen. Gällande revet, så bidrar kalbildningen signifikant till CO2 produktionen på ett rev, så till den grad att många rev tillför CO2 till luften. Det är vad marinbiologer o klimatforskare kommit fram till. Det finns mängder med artiklar, så jag postar inga, var o en kan söka. Gällande Borat som du skriver så är det intressant, som nog inte alla vet: Trots att borat bara utgör kanske 0.3 dKH av den totala alkaliniteten så bidrar den betydligt mer än så med sin buffrande egenskap. Skälet är att HCO3 jonen är en usel buffert i pH området 8 (alltså där vi egentligen vill ha dess effekt), medans Borat jobbar perfekt som buffert just där. Därför bidrar Borat en hel del till pH stabilisering trots att den endast utgör 0.3 dKH av det totala KH värdet. En buffert jobbar bäst inom sitt sk pKa värde, och för HCO3 är det pH 5.9. Det kan man se när man titrerar, att pH sjunker snabbt i början, men stannar upp vid pH 5.9, där tar alltså HCO3 jonerna upp H joner väldigt enkelt. Vid pH 7.9 för att vara helt exakt, är HCO3 jonen helt inert, den vare sig tar upp eller avger H joner. Det är för övrigt därför som om man tillför HCO3 joner till ett kar, så sjunker oftast pH värdet.(om pH är över 7.9) /Jonas
-
Mastertronic Essential
@Oscarhaglund , först vill hag be om ursäkt ifall jag reagerat lite onödigt starkt på dina analyser. Såklart har du rätt i att fundera, analysera och såklart även ifrågasätta. Du får gärna fortsätta med det, jag skall försöka hjälpa dig, och kommentera. Ca, KH, NO3 och PO4 (särskilt med red sea om du har lågt po4) är sjukt stabila i MTE och väldigt hög både accuracy och precision. Mg är dock svårare precis som du märkt, dels varierar det mer än man tror på salthalt, men det förbrukas ju inte mkt så variationerna skall ju va logiska. När man titrerar Calcium så tar man bort Mg ur lösningen med reagens 1 genom att höja pH. Detta är superenkelt och det blir oerhört selektivt, därför är Ca tester överlag ofta väldigt exakta, så även i MTE. Mg, där måste man göra tvärtom, ta bort Ca ur lösningen, även det med reagens 1. Det är svårare (för alla), då den reagensen kan under vissa omständigheter vara inte 100% selektiv för Calcium utan "ta ned" lite Mg med, och då blir värdet falskt lågt. Detta gäller ALLA magensiumtester. Ett annat sätt att kringå detta är att titrera ut totalen först (Mg+Ca), sedan gör aen ca titrering (som ju är sjukt stabil) och då blir Mg=total-ca. Detta innebär att varje gång man gör ett Mg test får man ett ca test på köpet, men det gör ju inte så mkt. men troligen skälet att nästan inga gör så (fast på lab gör man så). med det sagt, vårat selektiva Mg test är det bästa man kan få med den metodens vissa svagheter, vilket betyder att i de flesta fall blir värdena väldigt rätt, inom +- 30 mg/l. Men ibland på grund av temp, o annat kan Mg testet dippa ner kanske 50 mg/l. Lösningen är att kalibrera mg lite oftare med en ref vätska. Men med detta sagt, jag jobbar på att se om vi kan få Mg lika stabilt som Ca, och det kan vi. men fram tills dess, Mg är oftast tillräckligt ok, men behöver basernas lite oftare. Du minns säkert hur Hanna hade problem med sin Mg checker, det är lite av samma orsak. sen har du ju helt rätt, mg är inte särskilt noga att mäta ofta, ändrar sig inte mkt, men linjärt med salthalt, men det rättar man ju till ändå. har du mer fårgor svarar jag gärna på dom här:-) Allt gott Jonas
- Igår
-
Ny hemsida ,Stor sändning med fisk
Nu har vi laserat våran nya hemsida, som är bättre på allt, Lite småfix kvar, largersaldo uppdateras allt efter. Större sändning med fisk, pall från de jong med prylar. Välkomna in www.aquariatech.se Fraktflygargatan 18, skarpnäck, Stockholm. Ons-Fre 11-17 Lör-Sön 11-15
-
Markera annons som såld.
Tack. Det verkar inte fungera
-
Jonas Aquaforest Oceanguard 435
Jag är väldigt nöjd över lamporna i förhållande till priset. Haft lamporna sedan 2019, bara en av dem jag fått byta ut på garanti. Japp, ett gott tecken på att de fungerar när korallerna växer 👍
-
j0nas Nyos Opus 300
-
Jonas Aquaforest Oceanguard 435
Najs, då kör vi ganska lika jag haar också AI blades och hydra 32 tycker det är ritkigt fint ljus faktiskt enligt mig det snyggaste ljuset att titta på. Syns ju även i ditt kar att det funkar fint för att få koraller att växa på bra!
-
Jonas Aquaforest Oceanguard 435
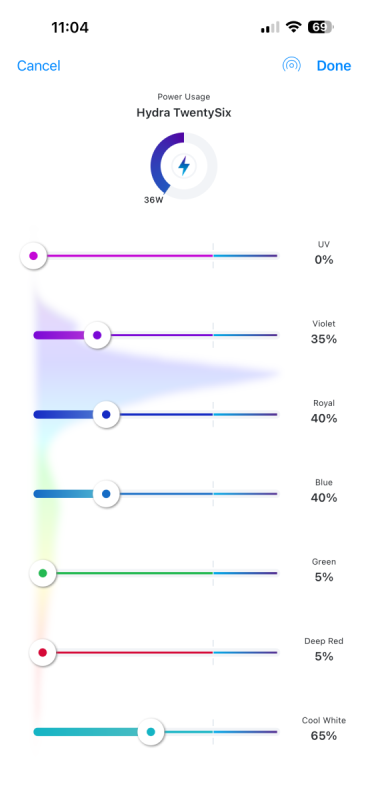
Tack! Jag har två stycken AI Hydra 26HD och har ljuset tänt mellan 9:20 - 21:00. Så här ser schemat ut:
-
Jonas Aquaforest Oceanguard 435
Riktigt fint akvarium, kul att se! vad kör du för ljus och hur lång tid?
- Förra veckan
-
Tribiani började följa Markera annons som såld.
-
Markera annons som såld.
Det går tyvärr inte för tillfället. Möjligtvis kan man gå in och redigera/ändra rubriken och lägga till "såld" på slutet.
-
Buggar efter uppdateringen till v5 250830
-
Buggar efter uppdateringen till v5 250830
-
Mastertronic Essential
Nu har jag mätt mot ATI referenz vätskan (1313mg/L) och fick ett resultat på 1180 vilket känns rimligt eftersom det skulle betyda att min Mg i akvariet ligger på ungefär 1300. Det verkar som att på något sätt så har kalibreringen ändrats och blivit knas. Jag har ju som sagt omkalibrerat stepperpumpen under tiden, så det kanske är det eller någon annan slgs SBS? Ärligt talat så har jag ingen aning. Men nu har jag kalibrerat om mot ATI referensen så det ska bli intressant att se om jag lyckas hålla kalibreringen den här gången.
-
Buggar efter uppdateringen till v5 250830
Det kan ha varit via vårt gamla tema. Vi får kolla upp det.
-
Buggar efter uppdateringen till v5 250830
Ja - j-a - det var bättre men för mig ligger den i det högra nedre hörnet och uppe till höger också🤣 MVH Lasse
-
Buggar efter uppdateringen till v5 250830
För mig lades den knappen till nere i vänstra hörnet. Jag hade inte den förut
-
Buggar efter uppdateringen till v5 250830
I den gamla modellen fanns en särskild knapp uppe i överdelen av sidan som sa "vad är nytt" Nu får man gå upp i menyerna/akrivitet för att kunna fråga efyter vad som är nytt. Vill gärna ha tillbaks snabbvägen MVH Lasse
-
Mastertronic Essential
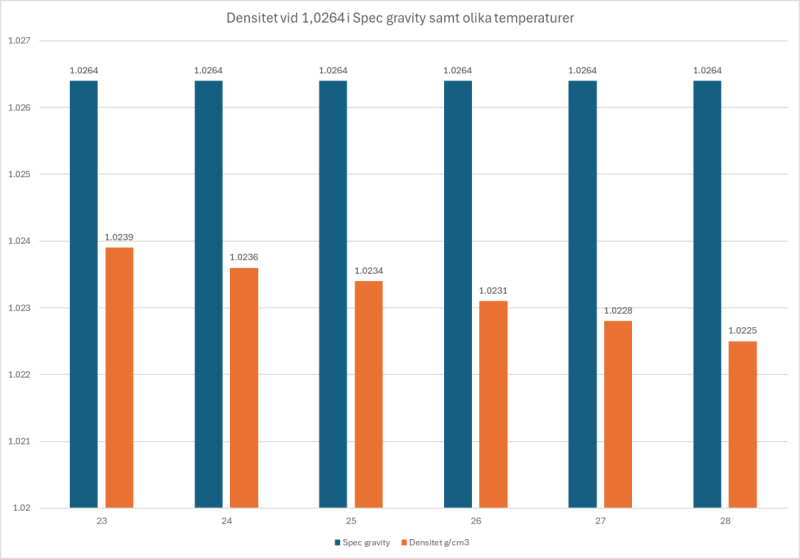
Jag brukar räkna så - Nu har jag kollat upp det bättre. Du skall använda densiteten när du räknar om och den är väldigt temperaturberoende. Vid en spec gravity (alltså din 1.026) ser omvandlingen ut som följer. Siffrorna hämtade härifrån Har du 25 grader använd 1,0234 om du skall vara petig😀 För fosfat och nitrat är ju det här inom det inbyggda felet - det är ointressant om din mätare säger 0,05 ppm att kalkylera med att det säger 0,05117 mg/L - här fungerar ppm=mg/L Samma oftast för Nitrat också - ointressant att skilja mellan 5 mg/L och 5,117 mg/L Men mäter du 1300 ppm så är det intressant att veta att det är 1330 mg/L när du jämför med ICP MVH Lasse