All aktivitet
-
Hur ofta skall man byta aktivt kol
Det finns en graf som även visar hur snabbt själva kolet mättas(det var den jag egentligen hade tänkt posta då den var mest intressant men postade fel) och i mitt exempel tar det också tre dar. Jag tror dom flesta kar är mer åt det högbelastade hållet, varvid jag tror man oftare är nära den sanningen att kolet mättas snabbt än inte, vilket också var mitt budskap.
-
Hur ofta skall man byta aktivt kol
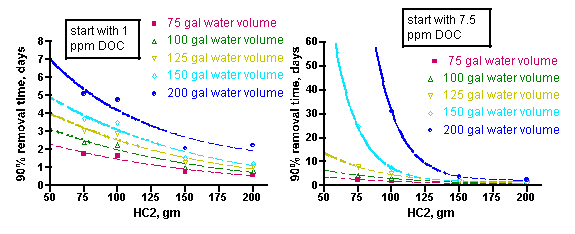
Min personliga tro och det jag brukar "säga" är att akvarister byter sitt kol för sällan. Jag anser att det oftast mättas mkt fort och sedan kan det läcka tillbaka dessutom i värsta fall. Personligen låter jag därför aldrig aktivt kol ligga i mer 2-3 dagar, sen kastar jag det. Låter det gå en vecka eller två och kör 2-3 dagar igen, med nytt kol såklart. Graferna nedan stöder detta, att kol "arbetar" mkt snabbt. Givetvis beror det på mängd kol, akvariets storlek o belastning, men som ett exempel: Om jag i mitt kar, cirka 600liter, "doserar" 200 gram aktivt kol(normal dos o faktiskt den dos jag burkar köra med) så har kolet till 90% procent avlägsnat DOC efter knappt 2 dagar. Jag tror alltså det finns belägg för att följa regimen att låta kolet verka högst ngr dar o sen kasta det. Hellre då också mindre doser o lite oftare kolfiltrering för en jämnare nivå. kolet läcker sen tillbaka dessutom om det får ligga för länge.
-
Makro men framför allt mikroelement
Håller med dig Stig, och är en av mina egna käpphästar, att level of detection för en hel del element som tex Triton lab analyserar är högre än NSW värdena. Gick igenom de där för ett tag sen så jag minns inte i detalj men minst hälften av ämnena vill jag minnas som triton lab levererar ut svar på har otillräcklig noggrannhet för vi skall veta om vi ligger rätt. Som du säger, vi vet bara att vi inte ligger över ett värde som redan det är för högt.
-
Makro men framför allt mikroelement
precis:-). Pedagogisk förklaring om Mg:-) ja de där med röd färg har man läst, men jag är väldigt skeptisk...eftersom dom flesta nog ej ens har strontiumbrist innan dosering är det nog vanskligt att ge strontium "cred" för eventuell färgutveckling. Jag tror det finns en liten fara för industrin vill ju sälja sina preparat, så det är snudd på bedrägerit när dom på sina flaskor hävdar att de o de ger den färgen. Det borde räcka att dom skriver nåt i stil med "vi tror det är viktigt att ligga så nära nsw som möjligt på samtliga element, men gör inga tillsatser utan att veta det exakta värdet innan"...typ..o det värdet kan vi ju bara få med icp-oes.
-
Makro men framför allt mikroelement
Vore intressant att skapa en tråd om mikroelement o vad vi vet, samt inte vet, tror, tänker gissar o spekulerar kring detta. Jag funderar på att skriva ihop en pdf som jag kanske infogar i mina föreläsningar sen om det aktuella kunskapsläget. Det gäller att gå försiktig fram där o hålla sig till det som verkligen studerats. Men utifrån det kan intressanta diskussioner sen uppstå. Skälet att att frågan idag, först nu efter alla år, verkligen börjar bli intressant, är ju att vi kan för första gången någonsin mäta dessa värden mha labtjänster. Med den vetskapen om vad vi har i vattnet ökar krav på kunskapen. Som spidermans styvpappa sa : "with power comes responsibility"..... Först ut: Strontium Det jag läst (samt tror en del): Strontium har mig ej veterligt visats behövas av koraller. Men teorier finns att Sr hjälper koraller att kalcifiera och koncentrera kalciumjoper osv, men inga evidens enligt de artiklar jag hunnit hitta. Dom djur man vet behöver strontium i form av att dom bildar strontiumsulfat mm är en del encelliga organismer vi sannolikt ej har i våra kar, eller i alla fall inte bryr oss om eller ser. Men inga studier har gjorts vad som händer om man kör koraller i vatten utan strontium (mig veterligt, men det kan ha ändrats). Strontium lagras i korallskelett, men det behöver alltså inte betyda att det behövs där, utan det lagras bara för att det finns i vattnet. Saken är förvisso den att kvoten Ca/Sr i skelettet är inte riktigt samma som i vattnet, talandes för att den skulle kunna lagras av en orsak. Men kvoten är mkt nära den när Sr spontant lagras pga av icke biologisk kalkbildning. En teori(från marinbiologer) är till o med den att strontium är giftigt för korallen så den måste göra sig av med strontium o då skickar den ut strontium till skelettet där den ej gör skada. Strontium förbrukas oavsett extremt långsamt och troligen då alltså i princip endast till följd av denna ovan beskrivna upplagring i skelettet (som alltså i alla fall jag tills vidare tror saknar biologisk funktion). En del har kört sina kar i åratal utan en enda Sr tillsats, och har ändå samma värde år ut o år in (ja lasse, min husgud tex;-:), men jag också sen jag började mäta.) Sr tillförs en del via mat dessutom (finns mätningar på att maten innehåller Sr i olika mängd) samt förstås vid vattenbyten om man nu mot förmodan innan bytet skulle ligga lägre. Sr är mest fritt i vattnet, men kan bilda Strontiumkarbonat(samt strontiumsulfat hos vissa encelliga djur som sagt). Det är mkt svårlösligt. Ordningen för löslighet för de olika karbonaterna är i fallande ordning med lägst löslighet först. Strontiumkarbonat, kalciumkarbonat, magnesiumkarbonat. Strontium är i höga doser giftigt, men då talar vi om värden långt över 8 ppm. På 80 talet skrev Fosse hur viktig det var med Sr(och jod) för man hittade det i skelettet. Det tror jag var en för snabb slutsats.
-
Vattenbyte hjälp tack.
sista prover ser ok ut. Inget som avviker sådär akut:-)
-
zooxanthellens roll i kalkbildningen
Att korallers kalkbildning skulle vara helt beroende av zooxantheller är väl ganska givet att dom inte är, dvs även en icke zooxanthelata korall kan bilda kalk. Således påstår i alla fall inte jag att zooxantheller är helt obligat för kalkbildning. Det jag menar är att det finns starka evidens för att zooxanthellen underlättar kalkbildningen. Det vet man empiriskt då zooxanthelata koraller bildar mer kalk i allmänhet än icke zooxanthellata, samt att inom de zooxanthellata bildas det mer kalk på dan. Så, då vet vi att zooxanthellen under den tid den fotosyntetiserar sannolikt påskyndar/underlättar kalkbildningen. Nu finns det tre olika teorier om hur det går till. Den teori du framför har jag inte sagt emot, tvärtom. Men jag är mkt mkt tveksam till om det skulle vara den enda mekanismen. Inget i biologin är så ensidigt. Så det jag skriver är att "min" teori(ej min såklart, utan jag framför det jag läst), sannolikt också spelar in. Det är mkt intuitivt o helt logiskt att tänka sig att fotosyntesens pH-höjande effekt underlättar for korallen att driva ut de vätejooner som krävs för att bilda kalk. Detta blir svårare o svårare ju lägre Ph värdet är. Oavsett om du tror det bildas CO2 eller ej vid kalkbildning, så vet jag att du vet att det måste frigöras H joner för att ur HCO3 bilda kalk. Eller om du så vill, CO3 används, HCO3 förskjuts då över till CO3 o avger H joner. I alla kalkbildningsskisser jag läst, så avgår vätejoner. Detta blir enklare om man i närheten har en zooxanthell som med liv o lust slukar dessa genom att sluka CO2. Du kan väl inte säga emot det? Den tredje mekanismen är att fosfat konsumeras av zooxantheller, o fosfat kan ev hindra kalkbildning. Den tredje mekanismen är jag inte lika säker på att jag tror på. Men dom två första, ja varför inte?
-
Nasarius, bra el dåligt?
Apropå sandsniglar. Min erfarenhet är denna: Nasarius bara förstör sanden. Dom äter upp dom för sanden nyttiga kräftdjuren. Ett överreklamerat "djur" som inte gör någon som helst nytta utan snarare tvärtom. Helt värdelösa tycker jag. Jag säger inte att jag vet men tror detta. Mitt största dinoutbrott o överhuvudtaget period med sandproblem hade jag när jag hade som mest nasarius.
-
Föreläsning
Skissar på en ny föreläsning i saltkemi, snäppet mer avancerad, ev skall jag till Karlstad o hålla den. Men pratar gärna på fler ställen. Alk, kalcium, kalkbildning, karbonatjämnvikten, kalkreaktor, balling, ev ngt om spårelelemt typ "vad vet vi o vad vet vi inte"..blir huvudämnet.
-
Denna tro på bakterier på burk...
Fast det skall du nog jämföra med att starta om ett kar..ej bara hälla ner bakterier..;-)
-
Behöver vi tillsätta Kalium?
stämmer ju rätt bra med mina tritonvattenenprov. Jag har mätt i över ett år o som sagt aldrig tillsatt kalium o inte ett uns har det sjunkit på ett år. Okej, jag byter vatten men vattnet innehåller bara normala halter så det tillför ju inte ngt extra.
-
Ny vända...tillsatsers effekt..vad vet vi??
Ja den teorin figurerar. Någon har alltid någonsin sagt något någon gång.
-
Ny vända...tillsatsers effekt..vad vet vi??
Väldig bra inlägg o intressant diskussion:-) den länk förresten som länkas till ovan har jag läst. Jag tycker den artikeln är helt värdelös..bara en massa tro o tyckande i enlighet med förvisso hans erfarenhet men precis som Lasse säger, hur vet vi vad som gör vad? att elementen behövs ifrågasätter i alla fall inte jag, utan min undran va mer om element i överskott dvs över nsw kan ge positiva effekter? Jag är tveksam till det men å andra sidan kan man säkert med värden lite över nsw på tex järn, kanske kalium, kanske jod..ge en högre zooxanthelldensitet..eller tex koppar som kan ge en lägre zooxanthelldensitet..osv o på det sättet indirekt påverka färgen. Men min erfarenhet är ändå denna: det som påverkar färgen mest är 1) halten av nitrat o fosfat 2) ljus om 1 o 2 är optimalt för färgutveckling (smaksak) så tror jag beträffande övriga element det räcker att ligga på nsw värden för att kunna få precis hur starka färger som helst. (Naturliga färger alltså). Ehsan's kar på triton talar för denna teori. Han är unik i det avseendet att han kan ha spot on på alla värden då han ju kan mäta varje dag! Han siktar inte på värden över nsw utan spot on. O hans koraller är så färggranna en korall kan bli. Detta talar starkt för att vi inte alls behöver kan eller skall ligga över nsw med ngr element för att få färger (utom möjligen kh). och framför allt,vissa ämnen i överskott är direkt giftigt. Strontiim är ett ämne jag tror är helt meningslöst att tillsätta o har kansle ingen funktion alls. Det tror jag vara binds in för att det finns där men saknar funktion. Till o med är det så att Strontium försvagar skelettet hos aragonit...
-
Ny vända...tillsatsers effekt..vad vet vi??
Är det verkligen sant att man får fram mer färger om man ligger till o med lite högre än nsw i vissa värden? Jag tror inte det. Sen angående aminosyror: Det finns en studie med aminosyror som inte visade på någon skillnad i färg alls, enbart att dom korallerna som fick aminosyror växte ngr mer vilket är logiskt. Dom fick ju mer mat. Men man såg ingen annan skillnad. Men visst, det var vara en studie så det behövs fler. Sen är jag tveksam till dessa studier som analyserar korallskelett o sätter likhetstecken med det innehållet att korallen behöver dessa ämnen. Bara för att ett ämne finns i skelettet betyder det inte att det behövs. Det kan ha tagits upp för att det finns i vattnet men ej för den sakens skull behövs. Det är ganska ologiskt att just skelettet skulle behöva ta upp ngr annat än kalciumkarbonat. Strontium till exempel gör skelettet skörare! Så det upptaget kan mkt väl vara bara ett resultat av att strontium finns och därmed oundvikligt i viss mängd tas upp. Alltså mer som en förorening egentligen. För biologiska processer behövs alla joner nästan men det är i så fruktansvärt låga halter så en brist på det är nog väldigt sällsynt.
-
Behöver vi tillsätta Kalium?
Kan vi verkligen likställa korallen med fanerogamer bara för att båda fotosyntetiserar? Jag har letat ihjäl mig efter en källa om det finns mätningar på koraller...hittade ngr artiklar men som kostade pengar. Men intressant med 21-4-7...skall räkna lite på det. Spontant tror jag det är för högt värde men säger inte emot dig då jag ej vet, utan bara tveksam...
-
Behöver vi tillsätta Kalium?
Sådana råd är livsfarliga...hur vet du med säkerhet vad du har i kalium?...en av medlemmarna både här o på fb hade 700 i kalium, fiskarna stendog. Det tvistas om orsaken men jag tror det berodde på "hyperkalemi". Sen får man ju inte färger bara för att man har mer av ngt, eller ens om man har rätt av ngt, möjligen tappar man färger om man har tydlig brist(fast nog knappast visat ens det). Dvs denna koppling mellan joner o färg känns extremt spekulativ och drivit fram en trend som i sin tur med jämna mellanrum lett till överdosering bland alltför många akvarister. Såklart är det inte bra med brist, men hur ofta har vi det?...och om vi har det på ett visst ämne, spelar det nån roll för just detta ämne? Finns ngn här, Stig?, som har länk eller uppgifter om kaliumförbrukning av koraller? jag har letat ihjäl mig, men hittar bara innehållet i som är analyserat av ARM på stenkoraller...men skulle vilja ha fler referenser. Stig du sa nåt om samma mängd som fosfat? Har du referens? Mvh Jonas
-
Behöver vi tillsätta Kalium?
Vill lyfta detta med att tillsätta kalium...jag pratar ej nu om Zeovit där zeoLITEN som ett led i sin jonbytaregenskap kan ta upp kalium. Jag pratar om vanlig drift utan kemiska absorbera, dvs hur mkt kalium förbrukas i ett kar pga av biologisk växt av koraller? Som jag alltid hävdat med en dåres envishet behövs mkt sällan kalium tillsättas och överhuvudtaget är det mkt mkt vanligare (o farligare) med för mkt element av olika slag, där i princip endast ca o KH är det som behöver tillsättas. Jag är verkligen fortsatt enormt skeptiskt till alla flaskor, för att inte tala om de sk "slow release" tabletten som ännu mer okontrollerat frisätter potentiellt giftiga joner av saker som knappt förbrukas. Jag vet att jag tjatar, men jag gissar into, utan har belägg. Jag mäter o mäter, med triton, o läser om olika element o deras upptag av koraller, o sen kan vi räkna. Sen ser vi ju rätt ofta , akvarister som har problem och det lyser rött på triton lan, och nästan jämnt är det att det är för mkt av nåt. Eller hur?. Så, nu har jag räknat lite på KALIUM, eftersom det är det ämne man pratar så mkt om och det tillsätts nog ganska mkt. Så, hur mkt sjunker kalium i tex mitt kar på ett år OM jag inte vare sig byter vatten eller tillsätter nåt?, om vi räknar med att det går åt 5kg reaktormedia på ett år, dvs det bildas CaCO3 av koraller o annat med 5Kg/år. Låt oss anta det...vi har ett utgångskalium på 400ppm. Nu gör jag ngr antaganden, kan vara delvis inkorrekta men inte i hästväg fel tror jag: Tittar vi på kaliuminnehåll hos koraller kontra Kalkförbrukning så har jag hittat en siffra där relationen K/Cavid tillväxt är cirka 0.14 promille! (tex kan man läsa på ARM media där det redovisas relationen av K kontra Ca hos stenkorall). Obs, denna siffra kan va fel men knappast avsevärt avvikande. Om det bildas 5 kg kalk på ett år (ungefär vad som förbrukas i min reaktor per år), så bildas det 50 Mol CaCO3 per år. Då går det år 2000mg Calcium. Då går det åt 2000mgX0.014% kalium=0.28 gram kalium. 280 mg kalium på mina 650 liter ger en minskning per år av Kalium med:0.43ppm!! Så om jag hade 400 ppm i kalium i mitt kar på nyårsafton så har jag nästa nyår om jag inte tillsätter ngt, 395ppm K. Det finns säkert felkällor i detta, tex att kalium kan förbrukas av annat, bakterier mm...men ändå....Jag kommer inte köpa någon flaska med Kalium...Sen har vi ju numera förmånen att veta, nämligen mäta med Triton. Jag skulle aldrig lita på ngt hobbytest när det gäller ngt annat än Ca, kh, Mg och fosfat(Hanna) för att ta beslut om dosering av ngt.
-
zooxanthellens roll i kalkbildningen
Lasse, tror du ändå inte att det kan vara multifaktoriellt? Som så ofta inom biologin är inte bara en sak rätt, utan fler mekanismer samverkar. Jag tror också din linje är en del i detta, men det känns väldigt logiskt att även CO2konsumpion på plats kan hjälpa. Korallcellen måste de faktum avlägsna två vätejoner ifrån HCO3, vilket blir svårare vid lägre ph, lättare vid högre...CO2 konsumtion driver 2HCO3---CO3+CO2+H20...åt höger osv...Jag tror båda mekanismerna samvarierar. MEN, du har helt klart en stark poäng i det faktum att vid topparna där ju inga zooxantheller finns, där bildas kalk snabbast...talandes för att just där funkar det utan mekanism 1 (jämviktsmekanismen). Sen har jag läst att matning med plankton ökade kalkbildning, talandes för din tes, men sen bildade dom ingen kalk på natten trots matning, talandes för "min" tes, vikten av CO2 konsumtion lokalt.Jag tror som sagt båda har betydelse. Men vem vet, allt är väl teorier egentligen som jag förstår det:-)
-
zooxanthellens roll i kalkbildningen
Här hittade jag en av artiklarna jag läst. Dom pratar här om tre mekanismer 1) den jag beskrev...co2 konsumption driver jämnvikten åt höger...mer CO3, et c etc..ja enligt ovan...eller om man så vill...lättare för H jonen att avlägsnas från HCO3 när CO2 sjunker pga av fotosyntes hos zoox. 2) Den tes du nämner, den bildade energin används 3) Zooxanthellen käkar fosfat, som i sin tur anses av en del hämma kalkbildningen . den sista mekanismen vet jag att du ej tror på, men 1 o 2 är nog rätt så okontroversiellt som vi båda framfört ovan. http://biostor.org/reference/9002/page/1
-
NOPOX tips sökes
jaha:-) trodde du hade räknat ut det...det hade vart coolt om det var så:-)...men köper helt din poäng
-
zooxanthellens roll i kalkbildningen
Det Lasse är också en faktor som enligt de artiklar jag läst stämmer. Dvs det finns fler orsaker..1) det som jag skrev ovan 2) det som du skriver, att korallen får energi av Xooxanthellen i form av organiskt bildade produkter 3) en mekanism till jag ej minns nu, lite trött idag. Dvs vi har båda rätt enligt de artiklar jag läst. Jag läste runt ganska mkt om detta både nu o vid ett tidigare tillfälle. Kalkbildningen sker EJ utanför Lasse, utan under celllagren, dvs det sker i ett intimt rum med zooxanthellen, korallens matrix o kalkskelettet, membran mellan men det transporteras mellan o över dessa, så det sker ej utanför. Se en schematisk skiss på en korallpolyp. Mjukkoraller har också ett skelett, fast annorlunda. Men det har inte med saken att göra, för bara for att det finns zooxantheller betyder inte att det MÅSTE bildas kalk, det är en bonus. Zooxanthellen favoriserar kalkbildning och mekanismerna är enligt det jag läst olika där alltså din tes också är rätt.
-
NOPOX tips sökes
Jag förstår din point Lasse, att värdet frun triton kan vara falskt högt så att säga...men om jag får 0.04 i fosfat (ja, uträknat) av triton, så är jag inte det minsta orolig eller tror att mitt sanna fosfat skulle vara 0...dvs att allt detta skulle vara organiskt. det tror jag faktiskt inte:-) men Lasse...detta med att andas...stämmer det verkligen???...hur har du räknat ut det eller mätt??...om det stämmer är det en intressant o lite lustig sak att veta...sådana små samband gillar jag:-)
- Gammal sand när man köper fungerande kar?
-
NOPOX tips sökes
Jag vet det Lasse, men vattnet är kristallklart o fritt från partiklar och jag tar alltid provet på morgonen innan jag matat osv, så jag tror den organiska komponenten är försumbar. Och sen så stämmer ju provet nästan helt exakt med Hanna som sagt, som bara mäter oorganiskt fosfor, så där får man en indikation på att det är nog inget man behöver oroa sig för, den organiska komponenten i detta fall.
-
Grumligt salt
Aquario, Som övriga säger så har kalciumkarbonat bildats. Dels kan det förstås bero på att du haft så hög salthalt i ett salt som redan är ganska högt i Ca o KH, så du kommit över mättnadsgraden för hur mkt Ca o karbonater som kan lösa sig..MEN troligen är det kombinerat med det faktum att du låtit det stå för länge. För om man blandar med kallt vatten kan du gå upp ganska rejält i salthalt innan du får en fällning! Jag blandar red sea koral pro som är mkt höga värden på ca o kh, ibland med en salthalt på 1.027 o det fäller inte ut kalk då, om man blandar i kallt vatten. MEN, när vattnet blir varmare, som det blir när det nyblandade saltvattnet får stå en viss tid såklart, så minskar löslighetsförmågan för kalk (detta beror på att löslighetskonstanten för kalk, Ks, sjunker vid stigande temp). Så man skall alltid använda nyblandat salt så fort som möjligt. Den mängd kalk som bildats kommer ej lösas tillbaka, mer än mkt mkt lite. Jag baserar det på ett antagande att du har ett ph i ditt akvarium som är normalt. Då löser ej kalk upp sig. Ja rent teoretiskt löser sig enstaka molekyler, men mkt lite. Först under pH 7.2 för calcit (som i detta fall) eller under 7.7 för aragonit(det kalk som koraller bildar) börjar CaCO3 i någon mån lösa tillbaka. Du har förlorat en viss mängd Ca och kh för gott, så du få ha koll på dessa värden o sen ev tillsätta det separat! MEN: den mängd kalcium o karbonater du förlorat, alltså den mängd kalk som bildats, är troligen mkt liten!. Skälet är att endast den mängd som motsvarar förändringen i löslighetskonstanren vid en tempstegring till 25 grader, fäller ut som kalk. Jag skulle gissa utan att ha räknat på det (men det går förstås) att du förlorat cirka 5% av ca och KH innehållet för gott.