All aktivitet
-
Ny artikel om KH
Ny artikel från mig. offentlig för alla. /Jonas
-
Balling
det stämmer, det är grundregeln, eftersom koraller konsumera lika mkt KH som Ca vid tillväxt. MEN, eftersom det finns bakterier som kan bilda/konsumera KH kan det i vissa fall, särskilt omogna kar eller kar med inte så mkt koraller , bli så att KH o Ca då o då inte konsumerar i 1/1. Då kan man tillfälligtvis får göra avsteg från regeln o höja eller sänka Ca kanalen separat. Men jaga inte siffrorna, så länge Ca korresponderar till KH ungefär så här , se bild, så dosera lika. OBS nu att detta också förutsätter ett balanserat recept som i princip ALLA är utom" Balling light”. Balling light är därför bara krångligt. kör alltid balanserade recept.(AMI) /Jonas
-
Fauna marine ICP vs ATI ICP ?
FM vinner med hästlängder: samma analyser men till nästan halva priset o ultrasnabb respons. Ganska svårslaget.
-
Kort presentation av Mastertronic
tror tidigast strax efter jul. Allt är klart men det tar alltid tid med transport, då vi ju inte skickar en, utan flera hundra. Räkna med januari. Allt är klart men logistiken tar sin tid:-)
-
Kort presentation av Mastertronic
Nu kära vänner är det nära. Jag får en fabriksversion till mig nästa vecka. Skall gå igenom allt en gång till, sen när jag ger grönt ljus startar vi bandet. Tack för erat tålamod med lite väntan, men allt är på gång o klart nu. Här kommer en liten appetizer från reagenskarusellen:-) Mvh Jonas
-
Hlgt6ph
det är i högsta laget, jag hade övervägt att koppla bort CO2 scrubvbern eller bara köra den nattetid.
-
Romans Balling 2 part
japp, deras är vanlig balling, ”faktor 1”. stämmer minska dosen till 1/3. mitt är alltså 3 ggr starkare, (om vi pratar om mitt sk mezzoforte).
-
Kort presentation av Mastertronic
Både ja o nej. Det kommer finnas ”sockets/powertronic” som MT kan styra av o på. Till dessa sockets kan du ju ha tredjepartsutrustning. En Dosetronic kan MT styra i detalj genom att ändra i doseringar från DT.
-
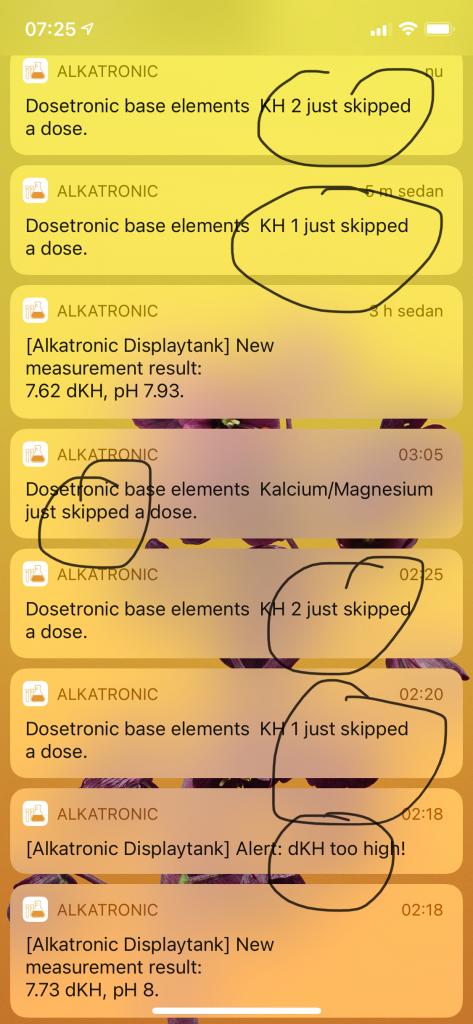
Felaktig core7 i mitt fall
Precis. Gott med lite support från er:-) För att ge er lite mer kött på benen så kontrollerade jag ”batchen” så här: 1 ml från 3a eller 3b (är exakt samma i dom) i 1 liter RO vatten. Den lösningen skall få ett KH på 10dKH. Det blev exakt 5.4 dKH. Alltså nästan hälften vad det borde vara. Sen gjorde jag samma från Ca dunken. 1 ml från den i 1 liter RO. Det skall bli cirka 120-140 PPM Ca i den lösningen. Det blev 80 PPM. Så nästan bara hälften där med. Sen blandade jag min egna ”core 7” lösningar, alltså mitt egna recept som likt Tritons skall va 7 ggr starkare. Gjorde samma test och fick 9.6 dKH. Dvs helt som det skall vara. Detta gjorde jag för att eliminera om jag gjort något mätfel men det hade jag alltså inte gjort och därmed är det bevisat att min batch från triton innehöll vara hälften mot vad den skulle. All denna info har Triton fått med endast svar att ”vi tror inte det är fel på batchen. ”. Då svarar jag att det är inte intressant vad vi ”tror” utan endast ”vet” så vänligen kontrollera batchen. Det har dom inte gjort. Därefter skickade jag in ett prov från batchen på inrådan från dom. Det är 3 veckor sedan och inget svar än. Till sist informerade jag Triton och skickade dom grafer hur mitt doseringsschema över en natt fick dubblas vid byte till den felaktiga batchen, och hur jag kunde återigen halvera schemat vid byte till min egna med korrekt koncentration. /Jonas
-
Felaktig core7 i mitt fall
Uppdatering: det har gått 3 veckor snart sen jag skickade in mitt prov på deras felaktiga batch utan svar. Det är riktigt uselt hur nonchalant man behandlar en felaktighet. Inte ett ord. Inget svar. Det enda var det initiala att dom inte tror på mig. Jag vet att min ”batch” var hälften så stark som den borde. med nu mitt eget recept har jag kunnat halvera dosen o allt är i sin ordning igen. Det slutgiltiga beviset. Alla kan göra fel och batcher kan bli fel hos de bästa. Det är hur man hanterar det som skiljer bra o dålig kundservice ! Jag har verkligen varit tillmötesgående, noggrann och samarbetsvillig. Men när det är sen total radiotystnad efter 3 veckor, när det handlar om att mäta ett ynka KH på ett prov dom tar 5 min, då är det inte längre ok. för de pengar jag nu sparar att köra mitt eget recept (alternativt andra billigare produkter) kan jag köpa många icp. Kommer uteslutande köra med Fauna Marines som är nästan halva priset mot en del andras med exakt samma info OCH doseringsanvisningar för den som vill. nu e jag sur;-) Jonas
-
Kalkvatten och fosfat
Vi räknar lite för skoj skull. CaOH2: 74 g/mol Löslighet 1.7g/liter Så 1 liter innehåller (in best case): 0.023 Mol Ca Såg att du har kalkvatten i ATON som är det klassiska, jag tar mitt eget kar som exempel: Då doserar jag ungefär 7 liter kalkvatten per dygn=0.16 Mol Ca Calciumfosfat kan bindas i olika former, men säg att det bildas som klassisk Ca3(PO4)2. Vi binder då 0.11 mol PO4 per dygn(som mest, säkert mindre, men ändå) Molmassa PO4=95g/mol, så vi binder: 10 gram PO4 per dygn!. I mina 700 liter motsvarar det en reduktion av fosfat med: 14 mg/l PO4 per dygn! Ja, du ser, nu har jag räknat med ”in best case” och då binder du hur lätt som helst hela PO4 poolen flera ggr om. Dvs, jag tror ditt kalkvatten hur lätt som helst förklarar o binder detta du sett:-) Jonas
-
Kalkvatten och fosfat
ja, jag tror faktiskt det:-) Tänk att det är ändå ganska mkt ca o OH du doserar, om alla ca joner du doserar pop detta sätt förenas med en PO4 jon blir det en hel del. Hur mkt CaOH doserar du per dygn? Vi kan ju räkna lite på det för skoj skull-
-
Kort presentation av Mastertronic
Ingår mikrofilter
-
Felaktig core7 i mitt fall
fick frågan om 5 litarna e kvar, JA, det är dom, det var 10 litrarna dom slutade med o bytte till 5 liter(enligt en distributör transportskäl). Dessa mina felaktiga dunkar var alltså 5 litarna. För mig var det den enda egentliga anledningen att jag körde med Tritons core7, att jag slapp blanda. Vill ej publicera batchnummer då jag inte kan veta om batchen är fel eller bara mina dunkar. Det är ngt Triton får göra o inte jag. Dom är informerade om batchnummer och har fått ett vattenprov från mig från dunken, samt bevisen på att mina dunkar innehåll i princip bara hälften. Rätt intressant, nu kör jag min egna som jag vet är 7 ggr starkare , och nu justerar AT ner schemat o ”skippar” doser(ungefär varannan), dvs adapterar sig för fullt till det nya receptet. Ett slutgiltigt bevis att dunkarna var felaktiga. /J
-
Felaktig core7 i mitt fall
Tyvärr inte helt olik attityd även från detta företag när jag rapporterade. för o ytterligare bevisa så lät jag Alkatronic justera ner själv till nytt schema när jag bytte till mitt eget recept och mkt riktigt skippade den direkt ganska så exakt hälften av doserna.;-) Jonas
-
Magnesiumkloridhexahydrat & kalciumkloriddihydrat?
för mig stiger nog pH runt 0.15 över ett dygn tack vare Na2CO3, o ungefär lika mkt till när /om jag kör CO2 absorber. Jag har slutat med absorber för då stiger min KH förbrukning till sjuka höjder;-)
-
Felaktig core7 i mitt fall
Hej. Vill dela med mig av denna erfarenhet, så ni är vaksamma. Jag har precis erfarit en batch core7, 5 liters (den färdigblandade) där KH delen är cirka 40% för svag!. Jag har alltså nästan fått över en natt dubbla dosen på doseringsschemat för att hålla KH värderna upe. Även Ca dunken verkar vara närmast endast hälften så stark som den borde, den kanalen har jag fått höja med 40% också från en batch till en annan. Jag har givetvis kontrollmätt, och är helt säker på att felet är cirka 40% i just dessa mina dunkar. Sedan blandade jag en egen, mitt egna recept Romans Forze7, som är exakt lika stark som en core7. Då var halterna korrekta igen, detta alltså för att eliminera att jag räknat eller mätt fel, men det hade jag alltså inte. Har kontaktat triton som vill ha ett vattenprov på batchen, det har dom fått. Det viktiga o varför jag berättar detta är för att ingen annan skall råka ut för samma som jag. Det är nämligen inte så enkelt att upptäcka detta om man kör med så låga doser som de flesta gör med core7. Jag har ju en dygnsförbrukning på 140 ml, så för mig var det enkelt att upptäcka när jag fick höja schemat till 270 ml över en dag för att behålla Ca o KH. Men för de som tex doserar 10 ml per dag, ingen ovanlig dos, kanske man inte tänker att det är konstigt att dosen går upp till 15-17 ml...kan ju fortfarande vara inom ramen för ökad tillväxt eller precision på pumparna. I mitt fall blev det alltså enklare att upptäcka , då dels för att mina pumpar är mkt exakta, men också för att jag rör mig med så stora doser. Detta föranledde alltså att jag kontrollmätte direkt på core7-dunken o kunde bekräfta felet. Förmodligen o förhoppningsvis är det en liten batch, kanske inte ens en hel batch? , kanske bara mina flaskor?, ingen aning, för jag har inte fått nåt svar än. Men var lite vaksamma, allt kan hända. Jag har tills vidare avslutat core7,(dom tog ju slut dubbelt så snabbt så jag har inga kvar, var tänkt att räcka året ut) och kör mitt egna recept, o är direkt tillbaka till normal dos 140 ml. Mvh Jonas
-
Kalkvatten och fosfat
Ja, Calciumhydroxiden har ett högt pH lokalt där den doseras (vitt moln), då blir det en del salter, en av dom är Calciumfosfat, som alltså bildas pgr av lokalt höga halter av Calcium joner och högt pH precis där du doserar. Jonas
-
Magnesiumkloridhexahydrat & kalciumkloriddihydrat?
Hej. Fraktfritt har öppnat igen 🙂 japp. Skjuter upp pH lite. Välgörande för de flesta kanske , i alla fall för mig med så mkt fisk jag har 🙂
-
Saltvattensguidens nyhetsbrev - Saltvattensbladet
Hittar ej
-
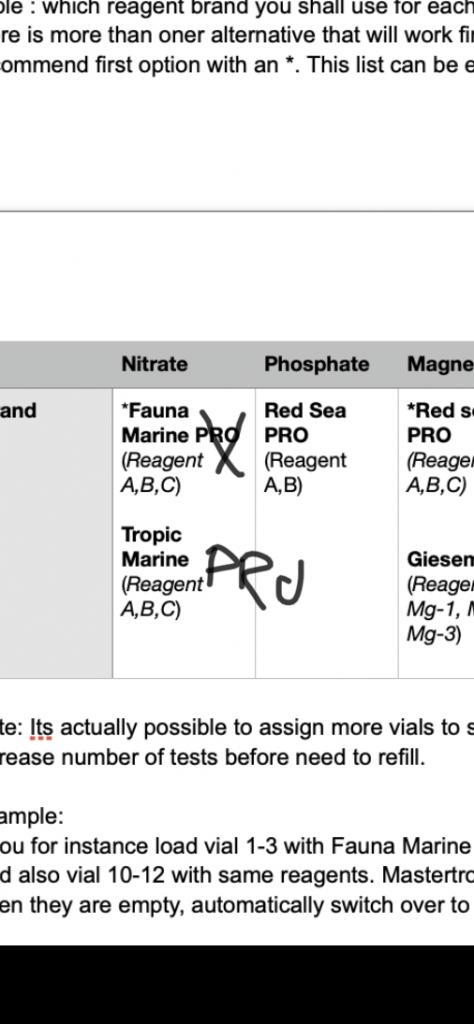
Kort presentation av Mastertronic
Både FM o TM, nitrat , är 3 reagenser. den ”fjärde ” är en referens dom skickar med. Den behöver du inte. tropic marine är exakt samma som FM. Spelar ingen roll vilken. 🙂
-
"Osynligt" bundet fosfat och nitrat
Intressant. Känns nog inte helt överraskande. Tänk på all fotosyntes du stängt av från både koraller, alla mikroalger inklusive cyanon. Tror absolut det kan förklara din höjning. Också upplysande hur lite som krävs för att rubba balansen. Personligen tror jag dock inte på mörkläggning som metod att liksom locks ut näringsämnena o sen eliminera dom , eftersom du lockar ut dom från ställen där du vill ha dom kvar. Tvärtom gör du nog mer skada än nytta för nu förflyttar du N o P poolen från det ställe där dom hör hemma o gör nytta (koraller, nyttiga mikroalger, annat mikroliv som fotosyntetiserar) till vattenkolumnen, och där blir dom nu plötsligt tillgängliga för allt o alla dvs även av de organismer du EJ vill skall få mer (tex fulalger). Att du skall hinna före o exportera dom tror jag inte är så lätt då biologin är snabbare. Totalt sett har jag svårt o se vilken nytta det gjorde. korallerna och allt annat nyttigt mikroliv får nu en uppförsbacke av att ha förlorat en del av sina näringsämnen. Dessa kommer ju bli trötta och behöva tid på sig att starta upp sitt maskineri varvid du kan i värsta fall ha vänt situationen till att få stigande näringsvärden även när du tänt ljuset igen o kör som vanligt. Till själva huvudproblemet är jag också tveksam till att mörkläggning är bra i något fall överhuvudtaget som metod. Cyanon finns kvar o kommer igen när ljuset tänds. Du bara dom sagt rubbar balansen o får kanske andra problem. Kör de vanliga sätten o det är inte en katastrof att ta till chemiclean till slut. Det funkar o du slipper rubba systemet. Ibland behövs lite ”läkemedel ”. Det är ju trots allt ett slutet system som kan få för sig att vilja bli en monokultur (cyano, dino tar över). Då kan chemiclean verkligen rädda ett kar. Jonas ps: jättefint kar du har!:-)
-
Kort presentation av Mastertronic
Sorry. Ett litet skrivfel har smugit sig in i manualen. Fauna marine. Ej PRO. api för att det är den enda fb med enbart flytande reagenser för Ca. vi kommer addera fler med tiden om reagensen håller måttet. Jonas
-
Romans Balling 2 part
legobitarna:-) haha tack, ja den va lite kul:-) fråga på:-) Japp, Na2CO3 är dubbelt så mkt KH/molekyl. o löser sig dessutom mer, så man kan öka koncentrationen med 3-4 ggr mer. Så vill man göra en ”core7” tar man 2 st 3.5or, det är så triton gjort. för att få 3.5 ggr starkare tar man cirka 181 gram Na2CO3 i 1 liter vatten. Vätejonen i den gamla vanliga NaHCO3 surgrör vattnet om pH är över 7.9, så den klassiska Balling leder ofta till att pH sjunker lite vid dosering med NaHCO3. NaHCO3 kan även höja pH, men först då pH värdet är en bit under 7.9. Alltså gällande NaHCO3: om pH i karet är över 7.9 kommer tillsättning av NaHCO3 ha en lite ph sänkande effekt, men om pH i karet är under 7.9 kommer det ha en liten pH höjande effekt. I sötvatten ligger denna ”gräns” mellan om den höjer eller sänker lite högre, snarare runt 8.3. Varför ligger denna brytpunkt på just 7.9 resp 8.3? Jo, det är nämligen den sk ändtitreringspunkten för CO3. Skall jag förklara det bildligt är det så här: Vid pH 7.9 ligger 100% av alla karbonatjoner som HCO3, 0% som CO3. Vid minsta pH över 7.9 kommer mer o mer ligga som CO3. Säg nu då att vi har ett pH på 8.0...då ligger en liten del som CO3, kanske 5% o resten som HCO3. Nu tillför vi lite HCO3 (NaHCO3) . Det mesta stannar kvar som HCO3 men eftersom pH är över 7.9 så kommer en liten liten del av de tillförda HCO3 jonerna gå över som CO3, dvs dom avger en H jon för att göra det, o därmed sjunker pH. Nu vänder vi på steken. Vi har ett pH på 7.8. Nu ligger 0% som CO3, nästan allt som HCO3 men inte riktigt allt, en liten liten del ligger nu som H2CO3. Vi tillför nu ytterligare lite HCO3, det mesta stannar kvar som HCO3, men liten liten del av den kommer nu gå över som H2CO3 eftersom jämvikten ligger så, varvid en del av de tillförda HCO3 jonerna alltså tar upp H joner ( o blir till H2CO3),. o pH stiger därmed lite. Mvh Jonas
-
Romans Balling 2 part
Djupdykt har jag. Lär gärna min artikel om Balling. Finns gör på SG. Inga restjoner. Na CL tas om hand i o med att du avlägsnar vatten då i då då salthalten stiger. Vi tillsätter ju inget NaCl extra i ballingen så det blir lika mkt export som import av NaCl.