Med risk för att slå in öppna dörrar.
Men jag tror ni måste enas om vissa begrepp, tex def av buffert.
Kurvorna i Jonas exempel är en (syra i vatten) teoretisk matematisk modell för att åskådliggöra buffertbegreppet och ingen vanlig titrering.
Det vanliga enklare sättet att beskriva det hela ( en buffert) står i texten på sidorna före.
Så här tror jag man skall se på det hela i en slutet systam.
I akvariet eller naturen blir det än mer komplicerat pga flera komponenter tillkommer och att systemet är så att säga öppet - CO2 som löser sig i vattnet och frisättningen av CO3 plus alla andra komponenter (tillkommer i buffertsystemet).
----------------
Vi börjar med en generell definition av en buffert :
1-" Villkoret för att något ämne skall kunna agera som buffert är att det i en lösning finns en hög koncentration av både svag bas som kan ta upp en stark syra och korresponderande svag syra som kan ta upp stark bas "
2-Buffertkapaciteten är förmågan hos en buffertlösning att motstå pH förändring vid tillsats av stark syra resp stark bas. Och bufferkapaciteten är direkt proportionell mot koncentrationen på bufferten.
3-Buffertförmågan är störst* när syrakoncentrationen = baskoncentrationen.
4-En tumregel är att en blandning av en svag syra och svag bas där pH inte avviker mer från pKa med mer än 1,5 kan sägas ha buffrande förmåga.
5-Då flera starka syror och baser finns närvarande i samma lösning ,kommer starkast närvarande syra alltidd att reagera med starkast närvarande bas.
--------------------------------
Alltså: I ett slutet system
-För Karbonatbufferten med pKa2= 9,3 så har vi " bästa kapacitet” pH 7,8-till-10,8 med max i 9,3
-För Boratbufferten med pKaB = 8,8 så har vi ” bästa kapacitet ” pH 7,3-till -10,3 med max i 8,8
om man då tillsätter en Syra vid pH över 10,8 enligt ovan i en ren karbonatbuffert med borat så är det mer som en ”neutralisation” av OH joner dvs större snabbare relativa förändringar av pH vid väldigt höga pH
och när det börjar närma sig 10,8 så övergår det i ”buffande verkan” dvs mindre förändring av pH när syrakonc närmar sig Baskonc. * Långsammare förändring vid pKa ( se nedan).
med långsammast avsees pH förändringen under en kontinuerlig tillsats av syra. ( jämför om man tillsätter en liter flermolar HCl syra på en gång i en liter buffert - DÅ GÅR DET SNABBT eller om du häller vattnet i syran då går det ännu snabbare MOMENTANT , hur var det nu ? VIS eller SIV). För er som inte läst kemi - ALDRIG VATTNET I SYRAN utan Syran i Vattnet SIV skall det vara.
när vi närmar oss 8,8 relativt mycket bättre buffertverkan runt 8,8 ungefär hälften av 1,5 .
Buffertverkanär bäst vid och bättre ju närmre pKa man kommer.
------------------------
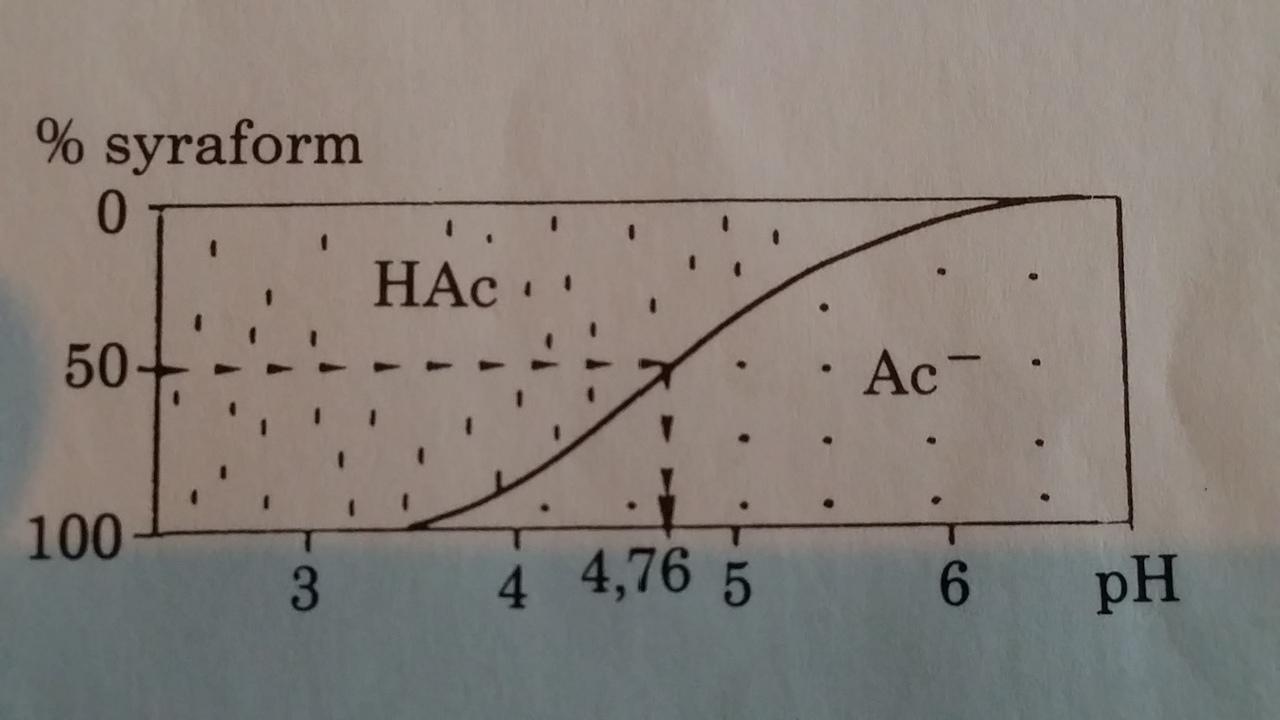
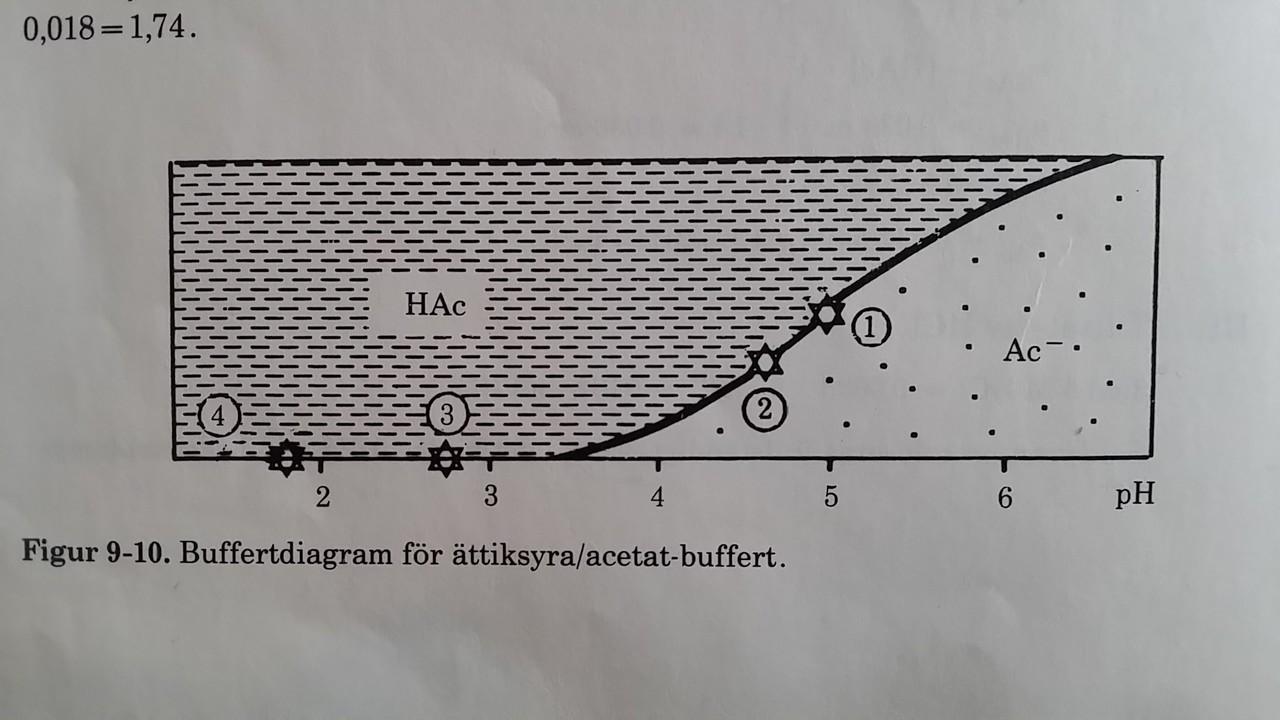
Buffertbegreppet är mycket enklare att förstå (och räkna på ) om man först försöker förstå en enklare enprotonig Buffert som tex en Ättiksyra/Acetatbuffert ( =HAc/NaAc, ättiksyra och natriumacetat ),
vi får då syra + vatten <=> bas + syra HAc + H2O <=>Ac(-) + H3O(+)
det är då också lättare att förstå varför pH förändringen är mindre runt och nära pKa
och så mycket större när Acetat är nära förbrukat eller förbrukat och man tillsätter mer syra eller tvärtom med Bas. Se bilder
---------------------
*långsammare: vid reaktion beror två reaktanter beror reaktionshastigheten på BÄGGE reaktanternas koncentrationer på bägge sidor om jämviktspilarna , sannolikheten för en syramolekyl skall kollidera är proportionell mot syrakoncentrationen dels mot vattenkoncentrationen.
Vid jämvikt ( vid pKa ) är reaktionshastigheten åt bägge hållen i jämvikten lika , före och efter pka är reaktionshastigheten olika därför får man olika pKa värden för olika syror och olika reaktions hastigheter bortom pKa värdet.
-----------
mvh PeterG