Jag var ju tvungen att kolla det här med Fe-EDTA i havsvatten. Tydligen är referensen för dessa mätningar Hudson, Couvault & Morel 1992, Marine Chemistry. 98:209-235. Dessa mätningar har sen reproducerats med annan teknik av Sunda & Huntsman 2003, Marine Chemistry 84:35-47.
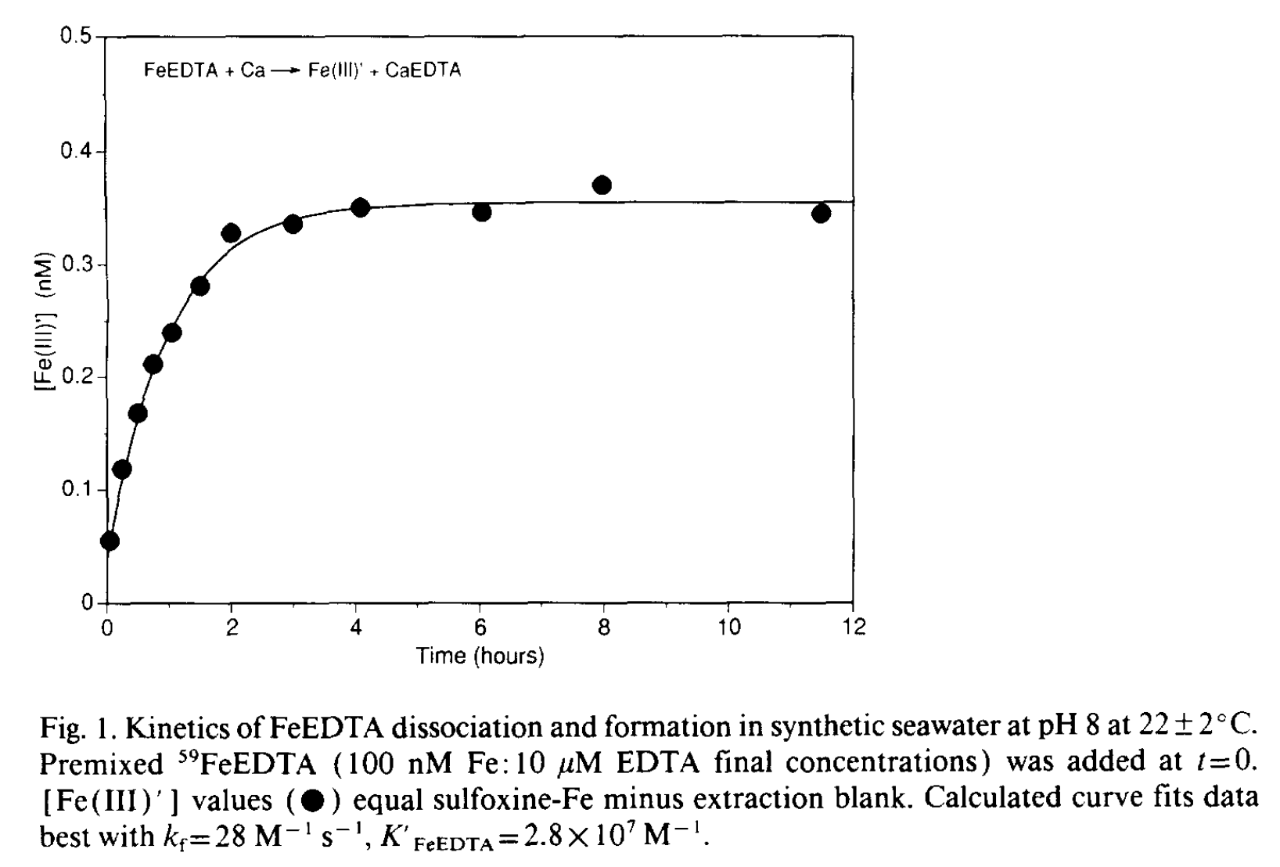
Jag tycker figur 1 i Hudson-pappret är pedagogisk. Den visar hur radioaktivt Fe3+ komplexbundet av EDTA tillsätts till havsvatten och så följdes hur mycket som frigjordes från komplexet vid 100 nM Fe (5,58 mikrogram/L) och 100X överskott EDTA, alltså 10 mikroM. Det tar uppåt 4 h timmar att nå jämvikt (anges i texten bero på de höga halterna Ca2+ och Mg2+i havsvatten) men kring 0,34 nM blir tillgängligt som fria järnjoner (som alltså är biotillgängliga) under dessa förhållanden. Koncentrationen järnjoner ligger i samma härad som IPC-testat som @nike83 har gjort. Där uppmättes 23,7 mikrogram/L nu i dec.
.
Båda studierna visar att Fe-EDTA komplexens stabilitet sjunker när pH ökar, kanske p g a att hydroxi-EDTA-komplex bildas: Ungefär 10X om man jämför t ex pH 7,8 och 8,3.
Lästips:
https://www.sciencedirect.com/science/article/abs/pii/S0304420303001014
https://www.sciencedirect.com/science/article/pii/0304420392900359