-
Antal inlägg
16 831 -
Gick med
-
Senaste besök
-
Dagar vunna
387
Typ av innehåll
Profiler
Forum
Kalender
Galleri
Saltvattensguiden.se ideell förening dokumentportal
Bloggar
Frågesport
All aktivitet
-
@ remne Tror du detta kan vara något för mina 30 wattare?https://www.elfa.se/elfa3~se_sv/elfa/init.do?item=75-214-42&toc=18920 Jag får mata den med 36 volt och bör då få ut 34 volt som bör? överstiga den sammanlagda forward voltage:n. Kan det vara en fara att teoretiskt ha en för hög möjlighet till forward voltage om strömmen är begränsad till 1000 mA? Ps skulle den räcka till att koppla 3 st royal blue chip enligt min länk ovan i serie och driva med 36 volt (enligt faktabladet kräver de 10 - 12 vol forward voltage och denna ger 32 volt ut 1000 mA. Tre i serie skulle ge 10,66 volt per chip - och fortfarande 1000 mA enligt mina 40 år gamla kunskaper MVH Lasse
-
Det fanns bra drivers där också på den listan jag länkade till. (http://stores.ebay.com/acrc/category2095454018-/_i.html?rt=nc&_fsub=2095454018&_sid=167758548&_trksid=p4634.c0.m14.l1513&_pgn=2) Och jag håller med dig att det är bättre att ta en som är strömbegränsad än en vanlig batterielemenator och om man tog en batterieliminator så skulle man kanske välja en som bara ger 0,8 - 0,9 A för säkerhets skull. Problemet för både mig och Manne är att Manne försöker utröna om det går att köpa in reservdelar från Fishstreet (deras dioder) och göra en DYI lösning av det. Manne är intresserad av de blå och jag sitter redan här med 3 st vita 30 - wattare. Vi har luskat fram att 30 wattarna kan drivas på 1 A konstantström men kan inte få fram forward voltage. Eftersom det är 8 dioder i 3 som det ser ut paralella rader på dessa chip så skulle jag inte vara så överaskad om fv är någonstans mellan 25 och 30 volt. Jag har sett detta chip lysa med hjälp av en billig 20 watts batterieliminator - dock under kortare perioder och det är inget som jag skulle prova på under en längre period.. Manne vill åt det 13 watts starka royal blue chippet men vi har inte fått fram varken den konstanta strömmen eller fv. Länken jag plockade fram är ett chip som har definierat vad som behövs i drivers och som finns i många olika färgtemeraturer från 6000 K, 10000, 16000, 20000 och royal blue. En perfekt mix för oss saltvattensakvarister i ett dyi bygge. Detta är iofs inte gratis heller. Ett chip kostar 10 dollar, drivern mellan 6,5 och 10,5 dollar (beroende på om man vill mata med 12 volt eller 240 V och om man vill ha 900 Ma eller 1000 mA (livslängd och effekt på chip)) Kylfläns 5 dollar. Alltså ca 25 dollar per paket, frakt som är hög på första delen av varje - lite billigare på efterföljande plus tull och moms. Skulle jag köpa en enhet royal blue, den dyrare drivern (fri frakt), en heatzink så skulle det gå på ca 31,5 plus tull och moms - ca 40 dollar = ca 275 kronor (efterföljande lite billigare). På mitt akvarium skulle jag vilja ha någonstans kring 200 watt LED - vilket skulle ge någonstans kring 5000 kronor plus tillfredsställelsen att bygga ihop som jag vill Av detta är Heatzinken ca 25 % så där kan man tänka sig en större och med hjälp av duktiga elektronikgubbar här så skulle man kanske kunna finna en större driver som klarar fler dioder än en. @ Manne Kan du ta och identifiera vilken driver som är till de blå, räkna antalet blå moduler, slå på och mäta ström och spänning från drivern. Du måste också se om de blå modulerna är serie eller parallellkoplade i rampen. sedan kan vi nog räkna ut hur det förhåller sig MVH Lasse
-
Tja - jag delar inte de flestas synpunkt om att det måste vara RO vatten för att det skall fungera. Dock - om man inte kör RO-vatten så måste man veta lite om sitt kranvatten. Du har redan upptäck att man på landsbygden i Skåne oftast har både kalcium och karbonat i vattnet redan (något som vi exempelvis saknar i Göteborg). Då får man välja ett salt som är avsett för vanligt kontinentalt vatten, alltså inte lika buffrat som revsalterna. Nästa parameter du måste ha koll på med borrad brunn där du bor är nitraten. Det är inte ovanligt med nitratnivåer i odlingsbyggd på över 50 ppm redan i dricksvattnet. Har du nitrat i vattnet - kör med osmos och skaffa dig en boosterpump. MVH Lasse Ps, det verkar dock inte som du har nitrat i ditt vatten. Den uppmätta nivån av nitrat härör med största sannolikhet från ditt nitritvärde. Gör en nitrattest direkt i ditt kranvatten.
-
Ta en bild så det framgår vart det inte blir tätt? MVH Lasse
-
Lite offtopic och inte alls för att mästra - endast för att försöka förstå vad du menar. Med chrimnoider menar du röda mygglarver (vilken är en typ av chironomider) ? Eller har jag missat någon djurgrupp? MVH Lasse
-
Manne - titta här http://cgi.ebay.com/10W-455nm-Royal-Blue-LED-Panel-Aquarium-/220709952109?pt=LH_DefaultDomain_0&hash=item3363569a6d Dessa går att driva med en vanlig 1 amp 12 volts DC adapter vad jag kan förstå. MVH Lasse
-
Det är 36 watt i clownhotellet och min erfarenhet säger att det funkar för många koraller. Dock kanske inte de mest ljuskrävande stenkorallerna. Se min tråd om Clownhotell och även månadens kar december 2008 (tror jag det var). MVH Lasse
-
Jag har Malwaresbytes Anti Malware 1.5 MVH Lasse
-
http://www.youtube.com/watch?v=m0l8wtBPGmk?fs=1&hl=sv_SE MVH Lasse - årets understatment
-
Håller inte med om detta - men det är viktigt att de krav som finns, hur dumma de än verkar, följs både av handlare och privatpersoner. Det nya med L80 (sedan något/några år tillbaka) är att det även omfattar privatpersoner. Där finns krav på tillräckligt utrymme med avseende på fiskens storlek och beteende. Det finns alltså inget behov av ett nytt förbud för privatpersoner av att exempelvis ha haj i alltför små kar, detta förbud finns redan inskrivet i L80. Är det krav som finns i tillämpningar och lagtext som ettdera är out of date eller i verkligheten motverkar bra djurhållning så är det bara att försöka genom upplysning och disk. ändra myndigheternas inställning till frågorna. Exempelvis - med en så bred djurgrupp som fisk så kan man inte ställa generella krav såsom grus på botten för att efterlikna deras miljö eftersom många fiskar vi har uppträder pelagiskt och inte har ett beteende som befrämjas av grus på botten. I en affär och i en karantän så motverkar också ett krav på grus på botten och gömställen en bra djurhållning. Ur smittospridning och rengöringsasspekter så kan det vara bättre med en mörkmålad bottenruta än grus. Kravet på sand och grus på botten som iofs är välment men får många gånger en verkan som ger onödigt lidande för våra djur. En fisk i ett försäljningsakvarium eller karrantän är där förhoppningsvis en mindre tid och då är det bättre (enligt min erfarenhet) att man optimerar skötseln än ett naturligt beteende. I fiskodling finns exempelvis inget krav på sand på botten, eftersom alla förstår att det skulle vara en katstrof vad gäller parasiter och andra sjukdomsframkallande organismer. Samma gäller det generella kravet på inredning i ett försäljningskar. För vissa fiskar behövs det men för de allra flesta så är det viktigare med att det finns tillräckligt med fisk i akvariet för att ge en trygg miljö. Vissa fiskar som ciklider tar direkt en sten eller ngt annat som revircentrum och påbörjar en slakt på sina "kompisar". Bra djurhållning där är rena kar med mycket fisk - då blir det inget onödigt lidande. Dessutom så vid hanteringen av fisk så finns en mycket stressande faktor och det är håvningen. Iofs så finns mycket vetenskapligt material som visar att fisk har förmågan att trycka ner stressreaktionerna vid upprepade störningar, dvs fisk som är vana med att en håv kommer ner med jämna mellanrum blir inte stressade i den grad att man kan mäta upp stresshormoner i deras blod. Men det motsätter inte det faktum att en human håvning skall ske snabbt och utan onödigt jagande. Det minskar stressen på både den håvade fisken och de som är kvar. Vad jag vill säga är att det finns gott om regler kring hobbyn men 1: Vi tillämpar dom inte. 2: De är alltför generella och den stackars tillsyningsmannen/kvinnan kan inte ha all den kunskap om de speciella djuren i just detta akvarium utan får då följa det generella som tyvärr blir fel ganska ofta. 3. Om vi skall få en bra och ändamålsaktig djurhållning av akvariefisk så krävs sammarbete mellan berörda myndigheter och hobbyfolk samt kommersiella aktörer. Med dagens kunskapssamhälle och informationen "in your fingertips" finns det otroligt mycket hobbyfolk vars kunskap både brett och spjutspettsmässigt överglänser den generella kunskap som förmedlas via etablerade kunskapskanaler. Vore rätt dumnt att inte ta hänsyn till detta om det man eftersträvar är god djurhållning. Har man dock inställningen att ingen djurhållning kan per definition vara en god djurhållning eftersom det inskränker djurets fria vilja - tja då är det bara att plöja på i förbudssvängen. MVH Lasse
-
Upptäckte nu varför den inte fungerade. Mitt Malwareprogram blockerade IP:t. IP är 89.208.136.100 Så en liten varning kanske.... MVH Lasse
-
Länken fungerar inte Stefan MVH Lasse
-
Övrigt snack Allt annat man kan tänka sig men dock inom hobbyn MVH Lasse
-
Andreas - nu talar du till två fullständiga analfabeter (åtminstone jag) inom det här området. Så långt är jag med att det bästa är ett aggregat som har konstant ström. Om man tittar på den krets jag fotade av så verkar den ju ha tre paralella liner med 8 seriekopplade LED och verkar vilja ha 1000 mA. Om jag matar den med en driver som ger 700 mA och 32 watt - skulle det funka någorlunda. Eller har du (eller någon annan) ett bättre tips. Jag är inte kapabel att bygga själv så jag är ute efter något jag kan köpa. Jag lovar också att skriva om dessa experiment så att flera kan dra nytta av dem. MVH Lasse Ursäkta att jag stjäl tråden Manne - men jag tror att även du är intresserad av detta - vi har nog samma idée. MVH Lasse
-
Politikerna tänker längre - se raden "flyttar naturrikodommarna från den fattiga världen till den rika världen" men vi måste sluta att gå på förmenta argument om miljönytta. MVH Lasse
-
Ytterligare ett projekt som flyttar naturrikodommarna från den fattiga världen till den rika världen under förespegling av miljönytta. MVH Lasse
-
Näe - varför göra det enkelt för sig - klippt från http://www.aquashoponline.com/29-maxspect-3w-high-power-led-bead-red.html Alla elektronikexperter - kom med tipps nu hur man kan fixa en drive till dessa chip Jag har frågat efter 13 wattarna också. Jag planerar att bygga en DIY ramp - nu samlar jag material. MVH Lasse PS Adressen till Semiled?
-
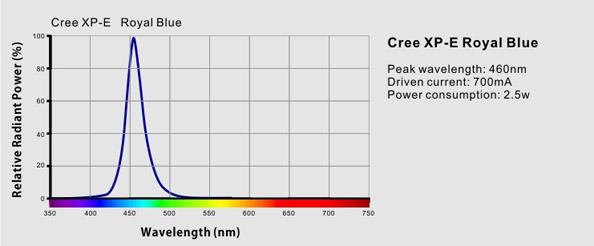
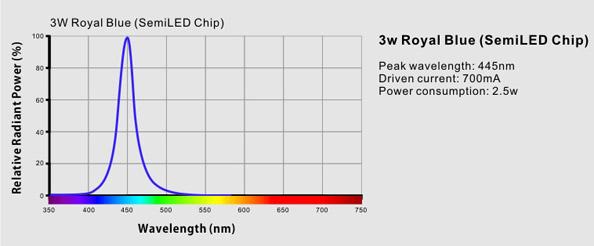
Fick fram det här: For maximum light output you can choose to upgrade the 3w white LEDs to Cree XPG 6700K chips. The 15w blue and 30w white and 1w violet chips are still Semi Chip LEDs. While giving a height light output the Cree LEDs also have a somewhat more yellow colorcast, around 11000K to 12000K when all chips are lit and around 6700K when only the 3w chips are lit. Customers are advised to consider this, together with the higher price of the Cree chips before ordering. Min rödfärgning. 15 wattaren är alltså inte Cree utan Semi - det betyder då troligvis att peak våglängd inte är Cree:s Se här på 3 wattarna royal blue MVH Lasse
-
Jag hittade det också För en minut sedan - här http://www.aquashoponline.com/29-maxspect-3w-high-power-led-bead-red.html Tyvärr var inte 13 wattaren med där. Jag misstänker att jag kan driva den med 700 mA men med mindre effekt. MVH Lasse
-
Här är 30 watts chippet Ser ut som det är 3 parallelkopplade grupper om 8 LED. Är det någon som har en enda idée om hur man skall driva detta? Går det att använda en 32 watts konstantström (350 mA) elektronisk ballast eller skall man använda en 24 volts ballast som ger 30 watt? MVH Lasse
-
Konstigt - det där ser mer ut som järnkaminer än elektroniska barlaster. Har du något 30 watts vitt chip i din Mac spec Manne? MVH Lasse Stig - hjälp till lite här (eller någon annan som kan)
-
Bra att det kommer nya bilder. det kunde vara kul om man kunde hålla liv itråden till nästa december och sedan kanske man kan rösta på årets "de va inte meningen"-bild. Koncentration då på roligheten och överraskningen - inte på forografens skicklighet, Då kanske alla "amatörer" som jag själv kan hjälpa till och bidra. MVH Lasse
-
Helgerån!!!!!! MVH Lasse
-
Hög salthalt knäcker inga snäckor - själv ligger jag på ca 36 promille - inga problem. Mina är också ute på natten, mest aktiva då. MVH Lasse
-
För genomförningar används tankgenomföring för det mesta. Se bild Tätningen in i akvariet, plastbrickan på utsidan. Har nästan aldrig varit med om att en sådan genomföring läckt. Vist kan du ha uttaget på sidan, det tror jag nästan är vanligare än botten idag. Tänk bara på att inte sätta det för högt upp bara. MVH Lasse
Saltvattensguiden
Organisationsnummer: 802438-6222
E-post: admin@saltvattensguiden.se
Aktuell programversion
Invision Community 4.7.20
Tapatalk 2.1.1