All aktivitet
-
Dino binder mkt fosfat
nej, dino dör inte av frånvaro av ljus, det krävs UVC med, som jag ju körde. Mörkret tvingar dino upp i vattenkolumnen, där tar UVC död på dom, cellerna går sönder, och N o P svämmar ut. Med den plötsliga stegring är jag säker på att det kommer till mkt stor del från denna celldöd, och endast mkt liten del till följd av minskat fotosyntesupptag. OM ökningen till stor del hade berott på utebliven fotosyntes så hade N o P sjunkit snabbare (jag förstår ditt resonemang med steady state men tror ändå jag hade sett en snabbare nedgång), men det tar en vecka innan jag kan se en minskning alls. Detta är ju inte ett dugg konstigt, vanliga alger dör inte av mörker i första taget, inte dino heller, men dino genom ett UVC (o visst lite annan phytoplankton med förvisso), stendör. Det som var intressant var hur mkt N o P som Dino verkar binda. För det enda som kan förklara höjningen (oavsett hur mkt o fort som sen förbrukas) är ju celldöd, dvs dino + phyto + minskad konsumtion. Det senare är en mkt liten del då koraller konsumerar otroligt lite P (då dom växer långsamt).
-
Dino binder mkt fosfat
hej lasse, postade en excelfil med datum o värden
-
Dino binder mkt fosfat
Inga grafer då jag testar min maskin med ref vätskor stup i ett, så därför istället en tabell som sammanfattar mina iakttagelser. Står desamma som jag skrivit i ord. Nu först, en vecka senare, börjar N o P sakta sjunka ner. /Jonas N o P utveckling före o efter Dinobehandling .pdf
-
Dino binder mkt fosfat
Exakt så. Däremot tror jag att korallernas fosfatupptag är helt negligerbart. Det är oerhört lågt. Det är väl bevisat med mitt fall då mitt fosfatvärde ligger fortsatt högt Trots en vecka med fullt ljus. Det som blir särskilt intressant är ju att jag alltid haft väldigt låga fosfatvärlden Det är därför jag tycker att man kan dra den här slutsatsen lite säkrare I just mitt fall.
-
Dino binder mkt fosfat
Exakt så tror jag också det är. Det är inte lågt fosfat i sig som är problemet och när man väl har Dino så tror jag att dosering av så väl kväve som fosfor bara ökar dino problemet för de älskar dessa näringsämnen. Jag tror att det är omöjligt att svälta Dino med att eliminera fosfor. Det går nästan inte för andra alger heller , de flesta Marina organismer klarar sig med oerhört låga halter. Det handlar således om att hålla en bra mikroflora och hur man nu gör det Ja det är ett helt annat kapitel. Där är jag enig med många att ultralåga näringsvärden är oftast inte positivt för en sådan mikroflora men ej heller ultrahöga. Det jag vill säga med detta inlägg egentligen, och till viss del kanske visat, är att när man har Dino så har man ofta samtidigt ultralåga värden men det är dinon i sig som ger detta så åtgärden är inte att dosera kväve/fosfor.
-
Dino binder mkt fosfat
Skall posta grafer. Grejen är, javisst vid mörkläggning dör kanske fler saker än dino, MEN, som sagt, såväl N som P är kvarstående högt en vecka efter med fullt ljus. Givetvis är inte 100% av ökningen beroende på dino med den största delen tror jag är det i och med att ökningen kvarstår trots att allt annat är tillbaka nu som vanligt Vad gäller ljus och så vidare.
-
Dino binder mkt fosfat
den kvoten stämmer för många alger med, så det är väldigt ospecifikt. Se ovan, nu 4 dagar efter mörkläggningens slut har inte po4, no3 gått ner, vilket jag tycker talar för att min teori är rätt, att no3, po4 stegringen kom i huvudsak från döda dinos.
-
Dino binder mkt fosfat
hinner ej lägga upp grafer nu men i text enkelt: PO4 och NO3 steg direkt när UV C hade dödat dinosarna, sen när ljuset gick på igen och UVC togs bort, ligger fortfarande NO3 och Po4 kvar på ganska höga nivåer. Dvs jag tolkar det som att det kom från dino, och ej på grund av sänkt fotosyntes under mörkerdagarna.
-
Dino binder mkt fosfat
När ljuset gick på gick EJ fosfaten ner, så ej heller nitrat, utan det som Dino frisatte när dom dödades är kvar i karet, nämligen ganska identiska värden på po4 och no3 fyra dagar EFTER mörkläggningens slut. Så detta var helt enkelt vad karets dino innehöll, så tolkar jag det i alla fall /Jonas
-
Dino binder mkt fosfat
Detta får mig också att fundera på följande. Vi pratar ofta om att låga näringsvärden ger Dino, och en del doserar N o P när de har Dino. Jag tror det är en feltolkning av bilden. De låga näringsvärdena vi ser i samband med Dino tror jag beror på dinon och inte tvärtom. Dino älskar nitrat och fosfat så doserar man det vid en dinosituationen, så tror jag man bara får mer problem. Det stämmer rätt bra med erfarenhet när man läser trådar hur folk kämpar med sina Dino(för egen del med) . Detta var en intressant iakttagelse och jag är beredd att vända på hela resonemanget kring Dino och näringsämnen.
-
Dino binder mkt fosfat
Den går från en dag till en annan dvs precis när dinon dör. Tror absolut inte att utebliven fotosyntes förklarar. Vanliga alger dör inte av 2 dagars mörker. Koraller tar upp väldigt väldigt lite fosfat. Detta är helt säkert från dinon. O kvoten 60:1 stämmer bra med dino (Korallers kvot vet jag inte men gissar är högre)
-
Dino binder mkt fosfat
Och helt väntat så har även nitrat stigit från nästan 0 till 5. Det ger en NP-kvot om man räknar i molar på cirka 60, så min slutsats blir att Dino tar upp ganska mycket näringsämnen i kvoten 60:1, och det stämmer nog ganska bra med litteraturen.
-
Dino binder mkt fosfat
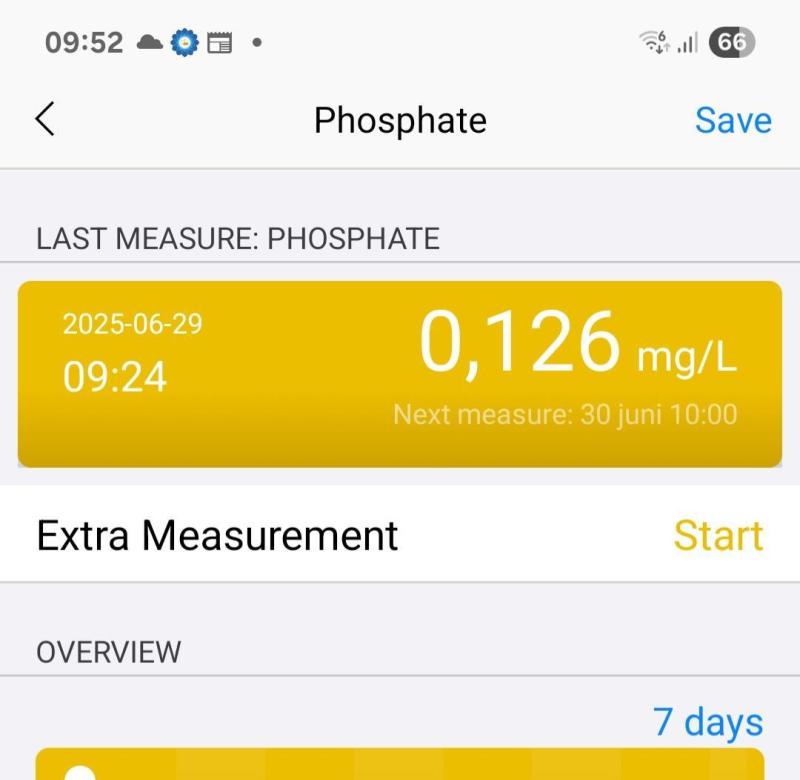
Detta är oerhört intressant. Dinoflagelater binder väldigt mycket fosfat, fosfor har jag förmodligen just visat. Jag har haft väldigt låga po4 värden , cirka 0,01 PPM. Jag har haft vit sand och inga problem med dino. Men sista veckan började dino komma "tillbaka" , dock ganska lite men jag ville "mota Olle i grind" så jag mörklade akvariet och körde UVC i tre dagar. Behandlingen avslutad idag och sanden är kritvit. Mäter PO4 idag rutinmässigt (mäter 2 ggr om dagen med min MTE) och då PO4 stigit till 0,13 ppm på enbart dessa få dagar samt den lilla fläck dino som dog! Det motsvarar 50 mg fosfat i mitt 500 liters akvarium och dinomattan var inte större än 10x10 cm. Jag drar slutsatsen att Dino binder mkt po4. Vad är hönan och Vad är ägget? Vi ser ju ofta låga po4 värden i samband med dino. Det kanske inte alls är problem med lågt fosfat utan det är enbart konsekvensen av den po4 slukande dinon. Ännu en gång en tankeställare att mäta näringsvärden varje dag tycker jag (nej det är inte smygreklam) Detta hade jag helt missat om "jag" inte gjorde min dagliga po4 mätning
-
Första oberoende reviews på MTE
Första unbiased recensionen av nya MTE. Fantastiskt roligt med denna recension.:-)
-
Nytt vattentest för organisk kemi
Ja det kan jag hålla med dig eftersom vi vet så lite om vad dessa världen ska ligga. Men om ett akvarium mår bra tror jag fortfarande vi kommer få stor variation så det kan nog bli svårt att förstå sig på resultaten oavsett om karet mår bra eller dåligt. Enklare med ICP för där har vi ju ett naturligt saltvatten hela tiden som referens. Ett test kostar ju nästan 1000 kr så det kommer naturligt ta tid innan vi får erfarenhet. Vi får väl se vad det här landar efter något år.
-
Nytt vattentest för organisk kemi
Väldigt spännande. Det är ju väldigt sällan man hittar en förklaring till ett dåligt fungerande akvarium; ett sedvanligt ICP test. Organiska ämnen har varit ett mörkt fönster, och detta är nog början på något väldigt intressant. Jag tror man ska använda testet om man har problem; har man inga problem kan det kanske lätt bli en övertolkning och lite farligt, men någon gång kan man väl göra det som stickprov av ren nyfikenhet. Men mest tror jag ändå att det är användbart när man har bekymmer. Jag kommer med säkerhet köra ett sådant test någon gång också även om jag inte har bekymmer man blir ju Nyfiken som sagt
-
Oscars 850l multi system
Hej Oscar, som vi även pratat om i annan tråd, kör på focusronics reagenser rakt av från början så slipper du bekymra dig att skölja ur slangar. Enda undantaget är fosfat om du har ett värde under 0,1 då rekommenderar jag Red Sea pro reagensen där, men i övrigt Focustronic för de andra 4a. Köp också refvätska som finns i butik (pma mig om du behöver veta vilken) kallas Ref A Ref B Ref C
-
Överdriver vi?
Bra kommentar ovan att ljuset kan ha högt par men allting har ju inte fotosyntetisk aktivitet och det får man ju ta hänsyn till också när man mäter 2000 par under starkt solsken nere i röda havet. Det finns mer av grönt och gult så den procentuella andelen PUR är ju lägre hos solljus versus akvariebelysning. Det som är så elegant är ju att DR har ju verkligen forskat kring detta. Det är så många av oss som gissar ( jag också) men här har vi en person som har verkligen studerat detta. Jag vänder mig rätt starkt mot att Ehsan D (Triton) gissar och säger att man kan inte grilla sönder en korall och hans belägg är att han står på en strand vid barriärrevet och svepen med handen ute över havet. Det är ganska nonchalant att stå på så tunna ben och omkullkasta DR fina forskning utan egen forsking som motargument. Vi måste i den mån det går vila vårt vetande på marinbiologisk forskning i de fall den finns. Jag vill än en gång slå ett slag för att ni läser DR artikel. Jonas
-
Manuell dosering av magnesium?
Ja det stämmer
-
Tutorials om ICP-OES/MS
En till, tutorials om ICP-OES/MS, i största enkelhet. /Jonas
-
Tutorials om Ca o Mg titrering
En liten enkel tutorials om Ca o Mg titrering, i största enkelhet. Kommer mer (om mätning) /Jonas Roman
-
Alkalinitet, mätning, lite teori mm
Såg det sen
- Alkalinitet, mätning, lite teori mm
-
Reef factory i konkurs
Tänk på att om du använder svavelsyra så ska man använda halva molariteten eftersom det är en tvåvärd syra. Det vill säga 0,1 Molar svavelsyra i samma som 0.2 N. Nu vet jag givetvis inte den erfordelige koncentrationen på våran ej längre existerande konkurrent, men om dom till exempel kräver 0,1 Molar saltsyra då ska man blanda 0,05 Molar om man baserar den på svavelsyra. Och så vidare Jonas
-
Överdriver vi?
Läst artikeln. Bekräftar påståendet i den här tråden. Ngr korta 1) Går man över saturationspunkten så blir det tom motsatt effekt. Inhibering. O denna punkt ligger oftast runt 300-400. Sällan högre. Ofta lägre. 2) Mjukkoraller behöver ibland mer ljus än SPS. 3) tridacna undantag. Har ingen saturationspunkt. 4) att mjukkoraller o musslor tål mer ljus kan bero på tjockare vävnad. Veckad vävnad. 5) I naturen har vi par upp till 2000 MEN, kompenseras av moln. Vågor. Bubblor i vattnet. Partiklar. 6) Färgutveckling hos koraller sker bäst när man är nära saturationspunkten. Går man över den så blir det motsatta effekt för då mår korallen dåligt och kämpar för sin överlevnad. Jonas