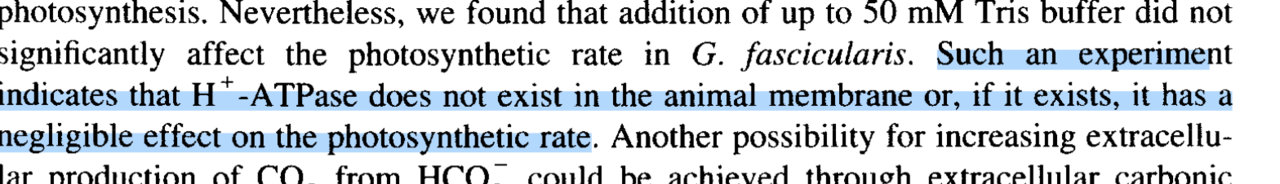All aktivitet
-
PO4 och NO3 i naturen
I snitt så lever de sk zooxanthellata korallerna till 70-80% på sina zooxantheller o resten via plankton. Det kan inom gruppen zooxanthellata koraller variera en del men i snitt ligger det där. Borneman har skrivit en bra bok om detta.
-
PO4 och NO3 i naturen
I naturen Nitrat 0.2 mg/l och fosfat 0.02 mg/l, men kan variera över tid som David skriver, men genomsnittlig ligger det oftast där om du tittar på olika mätningar. Framför allt blir det aldrig 0.00. Där har du skillnaden mellan de kar som ligger så lågt, där kan det bli helt noll, för i ett kar svänger det mer. Den andra viktiga skillnaden är att i ett kar finns inte så mkt plankton, så när zooxanthellen svälter pgr av nollade värden på N o P svälter även korallen, medans den i havet alltid har planktonåtkomsten som en ytterligare livlina. Därför tycker jag inte att man skall ligga på ultralåga näringsvärden i ett kar. Och med ultralåga menar jag under de riktvärden jag skrev ovan. Mvh Jonas
-
Koralldöd, inga alger och dino
siporaxen kan inte konkurrera med algerna om du i vattnet likväl har näringsvärden- Om du har nitrat o fosfat som du säger nu men ändå inga alger måste det va brist på nåt annat. Järn, jod? Menar du nu på sten eller glas? På stenen ser man inte mikroalgerna så lätt, där finns ju så mkt annat, men rutan är en bra indikator.
-
Högre nitrit än förväntat under uppstart
Vad menar du med död levande sten? Är det sten som är helt torr o helt fri fri från organiskt material, alltså i princip helt vit sten, eller är det levande sten med död vävnad på. Begreppet död levande sten är inte bra. Men om det är som jag tror så är det sten som en gång varit levande o nu är helt torr o även då i avsaknad av organiskt material. isåfall är ditt kar helt sterilt, och det tar tid för nitrifikationsbakterierna att komma på plats. Dom behöver ammoniak för att kicka igång, och det har du ju nu, så vänta bara ska du se, så kommer nitrit sjunka. Det tar den tid det tar och ditt värde är inte alls ,konstigt:-)
-
Alkatronic
Postar meddelandet igen, då det ej gick läsa i vissa webbläsare. @Lasse, prova nu igen /Jonas Uppdatering gällande Alkatronic Vi är glada att berätta att vår maskin kommer vara den första av nu befintliga, med inbyggd CLOUD-funktion från början utan behov av separat modul. Dvs fullt utbyggd möjlighet att nå din Alkatronic var du än är i världen. Jag vill också betona min tro på en fristående maskin, vilket denna maskin kommer att vara, med då så mycket mer frihet och möjligheter( vi bygger då vår egen programvara, och är ej bundna till möjliga brister i befintliga), jämfört med att låsa en maskin till ett specifikt akvarium-datormärke. Den enda "nackdelen" med fristående maskin är att du måste ha 2 program / appar på din telefon / Ipad / pc, medans fördelarna är enligt min bedömning så många fler, med tex obegränsad frihet att göra en skräddarsydd app för vårt syfte. Vi kommer att konstruera ett användarvänligt gränssnitt med grafer, varningar, etc., som enkelt kommer nås och kontrolleras med din app, via usb, BT eller wifi. När jag är med och designar programmet har jag alltid akvarietänket som högsta prioritet. Jag måste också säga: Om det trots allt blir så med tiden att en mkt stor efterfrågan uppstår på att göra en modul för att interagera med befintliga akvariedatorer, kommer vi att kunna göra det också. Men det viktiga budskapet här och nu är att det inte kommer behövas köpas till ngn extra modul, då alla våra maskiner kommer att ha inbyggd molntillgänglighet som standard och att vi ser en stor fördel i att kunna bygga vår egen app skräddarsydd för vårt syfte. Håll ögonen öppna, vi lägger ut bilder och mer information så snart vi är redo för det. Jonas Roman och Focustronic
-
Alkatronic
oj, konstigt, jag försöker posta om det
-
Alkatronic
Uppdatering gällande Alkatronic Vi är glada att berätta att vår maskin kommer vara den första av nu befintliga, med inbyggd CLOUD-funktion från början utan behov av separat modul. Dvs fullt utbyggd möjlighet att nå din Alkatronic var du än är i världen. Jag vill också betona min tro på en fristående maskin, vilket denna maskin kommer att vara, med då så mycket mer frihet och möjligheter, jämfört med att låsa en maskin till ett specifikt akvarium-datormärke. Den enda "nackdelen" med fristående maskin är att du måste ha 2 program / appar på din telefon / Ipad / pc, medans fördelarna är enligt min bedömning så många fler, med tex obegränsad frihet att göra en skräddarsydd app för vårt syfte. Vi kommer att konstruera ett användarvänligt gränssnitt med grafer, varningar, etc., som enkelt kommer nås och kontrolleras med din app, via usb, BT eller wifi. När jag är med och designar programmet har jag alltid akvarietänket som högsta prioritet. Jag måste också säga: Om det trots allt blir så med tiden att en mkt stor efterfrågan uppstår på att göra en modul för att interagera med befintliga akvariedatorer, kommer vi att kunna göra det också. Men det viktiga budskapet här och nu är att det inte kommer behövas köpas till ngn extra modul, då alla våra maskiner kommer att ha inbyggd molntillgänglighet som standard och att vi ser en stor fördel i att kunna bygga vår egen app skräddarsydd för vårt syfte. Håll ögonen öppna, vi lägger ut bilder och mer information så snart vi är redo för det. Jonas Roman och Focustronic
-
Min biologiska kamp mot cyanon startar nu
Uppdatering: Ang min cyano, där red slime hjälpte men ytterst tillfälligt. Eftersom jag fick cyano exakt när nitrat blev omätbart tror jag som sagt att det beror på nitratbrist nu i mitt fall. Ingen ovanlig iakttagelse om vi hör oss för. Fosfat däremot lite tendens att stiga, också helt förväntat när nitrat nollas. Jag tror på biologiska metoder, ofarliga metoder samt att behandla orsak mer än symptom om möjligt. Då jag tror orsaken är nitratsvält just här som i sin tur gör att mikroalger ej trivs(makro med såklart inkl zooxantheller!) ger det cyanon fördel då den kan fixera kväve från luften o därmed ej lider av nitratbristen. Dessutom stiger fosfat när nitrat nollas vilket ytterligare favoriserar cyano. Ja, så därför har jag ju doserat nitrat nu och ligger runt 1-2 ppm nitrat genom att varje morgon dosera cirka 700 mg Kaliumnitrat.(det höjer nitrat med cirka 0.6 ppm i mitt kar, dvs förbrukningen per dygn tycks ligga där). Så nu då till resultatet hittills: För tidigt att vara helt säker, men efter 5 dagar redan har cyanon minskat med 80%, vid störning av den kommer den tillbaka mkt långsammare o på stenen är den helt borta. Korallerna ser dessutom ännu lite bättre ut, där ngr var i ljusaste laget o nu fått en finare färg, och ser inte ut att ligga på någon nervös svältgräns längre. Fosfat har väntat nog dessutom gått ner från 0.03 ppm till 0.01(lågt, men jag är inte orolig då det går ner pgr av nitratstegring, då det blir en autoreglerande sänkning där sänkningen avtar när fosfat börjar ta slut).
-
Min biologiska kamp mot cyanon startar nu
Uppdatering Jag har mätt nitrat två gånger under ett dygn efter att jag har tillsatt kaliumnitrat och höjt det till 1 ppm. Karet verkar förbrukar ca 0,5 ppm per dygn. Under natten förbrukades 0,25 ppm, det vill säga jag tolkar situationen som att det är DSB'n som förbrukar den mesta nitraten trots allt just nu dvs inte så mycket Nitratförbrukning från zoox. Det är ju logiskt för jag har ju ultralåga näringsvärden från starten vilket betyder att microalger inklusive zooxantheller är tillbakabildade. Efter ett tag när microalger och zoox växer till lite tror jag nitratförbrukningen kommer öka ytterligare till följd av ökad microalgväxt det vill säga jag får höja nitratdosen. Jag får dock vara påpasslig, om fosfaten går ner så kan det bli tvärtom , då får jag sänka nitratdosen för att inte få ackumulering av nitrat. DSB'n konsumption av nitrat tror är ganska konstant däremot för den drivs ju av kolkälla som snabbt blir en begränsande faktor när nitrat börja stiga eftersom jag inte tillför kol. Och DSB kapacitet verkar som sagt ligga på ca 0,5 ppm per dygn, det vill säga i mitt fall cirka 325 mg nitrat per dygn vilket för övrigt motsvarar cirka 500 mg kaliumnitrat per dag. Som kuriosa motsvarar det cirka 12 gram(våtvikt) Caulerpa (racemosa) per dag. (Räknat hastigt med överslag så det kan nog skifta lite). Och nu till det viktigaste. Jag ser redan en tydlig tillbakagång av Cyano efter bara två dygns tillsättning av nitrat med höjning från omätbart till ca 1 ppm!!!!
-
pH-mätare duger denna?
Hålla med, köp en för kontinuerligt bruk. De där pinnarna man stoppar ner tror jag har en mkt stark tendens att behöva kalibreras ofta, vilket ingen orkar=du kommer få fler felvärden än rätt värden. Jag köpte en liknande den du länkar till o den blev inte långlivad. Visade i bästa fall rätt på +-0.1 men oftast mer fel än så. Beträffande kontinuerliga skulle jag råda dig att titta på lite fler än Milwaukee som länkas till här. Det är inget kvalitetsmärke, vilket priset kanske varslar om. Jag har haft en del produkter från dom (tex deras doserpump, som var riktigt dålig). Det är viktigt att enheten är spänningsstabiliserad, då pH mätning är mkt känsligt. En billig ph mätare kan mäta fel bara du håller i den, eller i sladden från elektroden, eller att den får störsignaler från pumpar o annat som du har i vattnet. Det är detta som kostar lite mer pengar, att bygga in kretsar som stabiliserar spänningen. När det gäller elektrod, så satsa på en lab-grade. Den håller tydligt längre än de billigare. Sköter du den kan du ha den i 1.5 år, men till slut måste alla elektroder bytas ut då silvret i silverkloridreferenselektroden tar slut med tiden. Skall man mäta, skall man mäta rätt, så det måste få kosta lite. Bättre annars o inte mäta alls, eftersom felaktig mätinfo är sämre info än ingen info alls.
-
Ny artikel
Ny artikel, denna gång från Lasse. Lasse delger oss sin kunskap och erfarenhet om ett biologiskt och intressant sätt att starta ett saltvattensakvarium på. Artikeln rekommenderas, den är en välbehövlig kontrast till andra sätt som dominerar idag. Artikeln beskriver en genomtänkt strategi och förmedlar samtidigt viktig biologisk kunskap. Tack Lasse för en mkt fin artikel. Jonas Roman/Redaktör SG
-
Dubbelsparande
såg det. Nu tror jag det skall stämma. Ser bara en nu.
-
Min biologiska kamp mot cyanon startar nu
För ett årsen hade jag problem med för högt nitrat. Korallerna gillade det inte helt (sps) o såg lite för mörka ut. Jag har ju DSB o den har hållt det i schack o 2 år men nu med ökad belastning räckte det inte till. Installerade därför en nitratreaktor som tog ner det från 25 till 2-5 ppm o där stannade det, idealiskt värde tycker jag. Men sen köpte jag mer ljus, o då sjönk det ytterligare till omätbart. Jag tror så här i efterhand att det var ljuset som tog ner det sista, zooxanthellerna fick lite extra eld i baken så att säga. Med detta omätbara nitrat kom cyano i princip exakt samtidigt. Jag har sett kar med cyano o högt nitrat med, men det är ingen nyhet för någon tror jag att det är vanligare i kar med ultralåga kvävehalter. Jag har varit grundskeptisk till nitrattillsättning men kommer nu att prova av 5 skäl 1) orsaken i just mitt fall tror jag är just lågt nitrat eftersom tidssambandet är klockrent, och vid normalt nitrat hade jag inte ett spår av cyano 2) fosfat har naturligtvis en liten tendens att stiga då nitrat är nollat, så ur den synpunkten också välgörande att höja nitrat 3) Andra medel mot cyano är antingen verkningslösa (tror tex inte ett skvatt på att dosera "bra" bakterier osv...det är förutsättnigarna för bakterier o annat mikroliv som är ogynnsamt, inte brist på sporer eller stammar osv), eller skadliga i nån omfattning mot koraller, och/eller innehåller antibiotika. 4) Jag har alltid försökt o trott på att angripa grundorsaken, dvs gå in i behandlingskedjan så proximalt som möjligt. Dvs kausalbehandling, inte symptomatisk. 5) Har alltid trott på biologiska metoder och det viktigaste: jag har just här sett tidssambandet så självklart provar jag. Är ju dessutom totat riskfritt att dosera lite nitrat, o inte minst; i princip gratis! Doserade upp i går så karet gick upp till 1 ppm (kanske lite lågt men jag börjar där) Mätte idag efter en natt, gått ner till 0.75...intressant: det betyder att troligen har dessa 0.25 ppm processats av min DSB under natten. Resten kommer säkert förbrukas under dan av zooxanthellerna. Sen skall jag mäta igen o räkna ut den dagliga erforderliga dosen av alltså Kaliumnitrat. Skall väl säga...jag har inte mkt cyano, men tillräckligt för att störas av det. Mest på sanden, men jag skall vinna över cyanon, o det skall göras på naturlig väg. Jag ger mig aldrig!.....;-) Jonas
- Alkatronic
-
Alkatronic
Hej! Skapar en ny tråd om min KH-maskin där jag tänkte samla all info om det fortgående arbetet med att få ut min maskin som en kommersiell produkt på marknaden ihop med företaget Focustronic. Vi har idag bestämt att den skall heta Alkatronic Arbetet fortskrider som det skall. Vi har blivit lite försenade för vi har fått konstruera nya drivkort till stegmotorerna, men nu fungerar allt som det skall. Likaså har vi valt med omsorg mellan flera olika slangpumpar, för att till slut fastna för en bra modell. Wifi, blåtand, cloud-funktion etc fungerar redan. Snart är den första fabrikstillverkade prototypen klar, och denna skall sedan hårdtestas av mig samt ngr från focustronic, och sedan även i en senare fas av utomstående. Därefter bygger vi en ny modell med slutgiltig design. Designarbetet har vi också så smått påbörjat. Vi kommer att tillhandahålla färdiga reagensvätskor. Jag tror inte på iden att kunden själv skall blanda reagensvätskor med en krävd noggrannhet på 0.5%. Vi gör det åt er. Vi kommer se till att priset för reagensvätskorna är såpass lågt så driftskostnaden för min maskin om ni mäter OFTA (cirka 8 ggr per dygn), kommer ligga i paritet med ett saliferttest i månaden. Det kommer gå åt om man mäter var tredje timma dygnet runt, cirka 400 ml reagensvätska i veckan. Troligen blir det behållare om 1 liter så man bara byter hela reagensflaskan var 2.5:e vecka. Vi kommer i startpaketet skicka med kanske 3 st (möjligen 4) reagens "1-litare". Sen kan man beställa fler av oss såklart. 4 st kommer räckan nästan 3 månader vid mkt frekvent mätning. Jag tror de flesta användare kommer minska mätfrekvens en smula efter ett tag till kanske 6 ggr per dygn, då räcker dessa 4 litade, i exakt 3 månader. Spillvattnet kommer inte pumpas tillbaka till karet utan till en särskilt behållare som användaren själv tar vilken plastbehållare som helst. Det rör sig om ifall man mäter var tredje timma, cirka 2.8 liter i veckan. Salthalten kommer teorietisk sjunka, men mkt mkt långsamt, då vi naturligtvis avlägsnar lite vatten för varje mätning. det går åt 50 ml akvarievatten per mätning. Jag har kört min maskin nu i 7 månader. I princip är det så långsam sänkning så detta är inget problem alls. Släng i lite salt på en höft i osmostanken, thats it. Mer noga än så är det inte. Jag har inte kunnat uppmäta en skillnad i salthalt en enda gång, trots nu 2000 mätningar under denna tid...dvs det är inte svårt att kompensera för vattenförlusten. Detta är som de som kör Balling fast tvärtom. Vid balling stiger salthalten långsamt över tid, här sjunker den. Kör man balling så kommer detta ta ut vartannat så det blir det tom ännu enklare att hålla salthalten. Kör man kalkreator får man som sagt slänga i nån dl salt i osmostanken samt bara mäta salthalten då o då o hålla lite koll. Det hade gått att installera en pump som pumpar tillbaka saltvatten men det ökar kostnaden, samt blir en massa slangar o meck som inte tillför något. Så till slut har jag valt denna enklaste lösning: tillsätt en skvätt salt då o då. Keep it simple. Ph proben behöver kalibreras högst en gång var 6:e månad(knappt det faktiskt). Den är oerhört stabil, o vald med omsorg. Kalibreringen är enkel i tar 5 min. Slangpumparna bör kalibreras varannan vecka. Tar 2 minuter. Enkel algoritm där man bara trycker på en knapp o sen avläser ett värde som knappas in. App till ihpone/ipad, wlan, usb o blåtand kommer finnas för alla möjligheter till kommunikation. Särskilt stolt är jag över att det blir alltså en cloud-funktion, dvs man kommer kunna nå maskinens mätdata osv utifrån hemmet! En liten display på maskinen kommer finnas också, men på sin dator, telefon etc kommer man få upp mer info såsom grafer, samt notiser om händelser, som tex att/om maskinen har doserat HCO3 eller stängt av kalkreaktorn. Alarm-alerts o gränsvärden kommer man kunna ställa in, samt få varningar i förtid när reagensvätska skall fyllas på (o när pumpar skall kalibreras) slangarna i pumparna är mkt viktiga. För bästa accuracy bör man byta dom 2 ggr om året. Vi kommer troligen bifoga ett set extra så man behöver ej köpa nya förrän efter 1 år. Som det ser ut idag är accurayn o precision 0.1dKH Nykaliberad maskin osv kan i princip prestera en noggrannhet på 0.05 dKH men det kan alltid finnas en variation i slangarna mellan två mätningar som märks först vid mättning nummer 10...därför kommer jag ev för att vara på den säkra sidan gå ut med 0.1 som officiell siffra. I princip finns ingen maskin som kan värde efter värde mäta med 0.05 precision, eftersom det finns ett fel i bara slangen på 0.5%. Labpumpar som kostar 20000kr/styck kan i bästa fall prestera en noggrannhet på 0.5%...så 1% noggrannhet(dvs ungefär 0.1dKH) är mkt bra för vår maskin o räcker på länga vägar för våra ändamål. Upplösningen är lägre, 0.02. Jag har valt att inte låta den avrunda, eftersom den kan förstärka ett litet mätfel (även förminska men man kan aldrig veta från gång till gång). Jag har lagt in en del algoritmer som kompenserar för ett plötsligt oförväntat mätfel (tex tillfälligt en luftbubbla i slangen)...då mäter maskinen om det värdet o sparar ej det felaktiga. mer info kommer med tiden Jonas
-
Apex AFS, Fish feeder med profilux?
I apexen med deras lite klumpiga programmeringsspråk ger man egentligen bara kommandon som av o på vid viss tid o vid på så är den det i 30 sek. Typ: osc 00/30/00 if time 12:00-11:58 then of vid ovstpende "kod" så startar den 11.59 o snurrar ett varv dvs en matning. Jag tror inte det finns ngn krets/intelligens i själva automaten utan den svarar bara på en 5 v signal till en motor. Vi för väl be nån sponsra oss så vi kan skruva isär en...
-
Red slime remover o snabb pH förändring. Varför?
Doserat red slime remover. PH märkbart lägre (se kurva orkar ej upp) och redox sjunker (se orpr). Teorier om varför? PH Sänkningen kan jag spåna över själv: beror ej på sänkning av alkalinitet dvs ej på bildning eller tillsättning av syra. Alk är oförändrad.(har mätt). Det måste bero på en CO2 ökning med andra ord. Men hur kan den komma så snabbt?? Minskad fotosyntes är det enda jag jag komma på som kan svara så direkt. Ökad produktion, dvs ökad bakteriell aktivitet, tror jag ej på. Det borde inte kunna svara så direkt. Och isåfall följdfråga: varför sämre fotosyntes vid dosering? Vad tusan innehåller detta medel? Det skall ju ej vara ett antialgmedel...eller är det det trots allt? Dvs stryper fotosyntesen hos cyanon?? Jonas
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
Jag måste också kommebtera(och hålla med dig) om att nu har jag ju bara talar om fotosyntesen. Du har kritiserat mig att det går ej helt koppla detta till kalkbildning o delvis håller jag med dig där också. Koppling finns, men pH värdet i sig runt korallen spelar också in hur lätt den kan bilda CaCO3. Vi har ju många studier som visar på ökad tillväxt vid högre pH (vet ej sweetwpot men sambandet ändå att högre pH favoriserar kalkbildning. ) hur får man ihop det med att fotosyntesen minskar om man höjer pH via utvädring av CO2? Då tror jag så här för att sy ihop säcken: generellt blir det lättare att bilda kalk vid högre pH. Det vet vi. Men samtidigt vid höjning av pH via utluftning av CO2 minskar vi tillgång på HCO3 o CO2 totalt sett varvid zooxanthellen fotosyntes minskar. Det har studien visat. Detta har en indirekt negativ effekt på tillväxten. Så länge den favoriserande effekten är större får vi en ökad koralltillväxt vid högre pH. Men när tillgången på kol blir för liten, läs fotosyntesen sjunker för mkt, överväger den biten varvid koralltillväxt avtar. Detta sker vid en sorts sweetspot som du säger. Den ligger var? Du säger 8.1...kanske.. kanske så??
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
@Lasse Artikelns sista del berör transport o nyttjandemekanism rörande HCO3, och kan belysa om det verkligen går åt nån signifikant energi för detta eller ej. Jag tror som sagt inte det är en eventuell energiåtgång att använda HCO3 som är orsaken till minskad tillväxt vid förhöjt pH vid utluftning av CO2, utan en minskning av total halt av HCO3(och CO2). I studien skriver man att det finns stöd för att korallen EJ har carbanhydras på sin cellyta, utan att det handlar om en icke enzymmediared spontan dehydrering av HCO3. I en av grafernam den sista, ser du att den förväntade fotosynteshastigheten är ngr lägre än dehydreringshastigheten, talandes för att den spontana dehydreringen av HCO3 till CO2 EJ begränsar fotosynteshastigheten. Dvs den spontana dehydreringen går faktiskt fortare än fotosyntesen. Man har sedan i försöket också adderat en buffert som hämmar en eventuell carbanhydrasmedierad HCO3-konvertering, och såg då ingen minskad fotosyntes! Slutsasen av detta är att det är en icke enzymatisk, utan spontan dehydrering som räcker för att förse korallen med sitt HCO3. Detta talar alltså ytterligare för att det inte handlar om en energiförlust som orsak att korallen växer sämre i ditt försök, utan faktiskt mer en minskad tillgång på kol. Det är bara i den zooxanthell som är helt odlad som man såg tecken på enzymatisk aktivitet av Carbanhydras, där man kunde se en högre fotosyntesaktivitet än den spontana icke enzymatiskt drivna dehydreringen av HCO3 till CO2. Tror du får lämna energiideen Lasse, eller i alla fall först bevisa den isåfall. Jag tror inte den håller. Du glömmer(eller?) att du minskar på totalkol när du gasar ut CO2 som sagt Se inklippta citat från studien:
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
För att vara mer tydlig, känner att det blir rörigt: Om man höjer pH med ditt sätt Lasse, att vädra ut CO2,(eller tillföra mindre), så kommer man minska på den absoluta halten av HCO3 och CO2. Såklart minskar då fotosyntesen, och därmed gissar jag tillväxten också. Alltså via vägen mindre kol till zoox. Om man däremot höjer pH genom att bibehålla mängden kol totalt sett, o bara förskjuter relationen (genom att dosera NAOH och ej låta vattnet stå i kontakt med CO2-innehållande luft), så kommer fotosyntesen tvärtom stiga då alltså korallen fördrar HCO3 framför CO2 enligt studien, (o koralltillväxten med stiga , men det gissar jag). Så ja, jag tror jag din korall växte sämre när du gick över pH 8.1 för att dess dess zoox fick mindre kol till sin fotosyntes. Det vore intressant om du kunde med den korall du sett detta även mäta fotosyntesseffekten o alltså ej bara tillväxten. För om du i ditt försök kan dessutom påvisa sänkt O2-produktion/sänkt fotosyntes när du mha av sänkning av CO2(aq) höjer pH över 8.1, då har du bevisat att din tillväxthämning nog snarare beror på sänkt fotosyntes o ej på energibiten. Herregud vad intressant:-) @Lasse, kan man få va med o leka i ditt lab så kan vi skriva en artikel tillsamman sen på riktigt så småningom?........
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
bump ,svarade ovan
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
Mkt i artikeln talar för att det inte är särskilt energikrävande för zooxanthellen att nyttja HCO3. Som du ser så stiger till o med fotosyntesen när man förskjuter CO2/HCO3/CO3 åt HCO3-hållet med bibelhålen total halt av oorganiskt kol. Om det vore en energikrävande process skulle kanske inte korallen prioritera HCO3-vägen, men det gör den enligt denna studie. Märk att det är korallen som styr in zooxanthellen på HCO3-spåret, eftersom den helt friodlade zooxanthellen inte svarade på samma sätt utan den föredrog CO2. Alltså finns ngt(troligen en HCO3 transportmekanism) i korallen som favoriserar för korallen HCO3-vägen framför CO2. Det hade den kanske inte valt om den vägen skulle vara så energislukande som du tror??. Håll med om att det är ett observandum att den till o med föredrar HCO3 jämfört med CO2. Det kunde dom visa tack vare att ändra pH i vattnet med en syra eller bas o ej låta vattnet stå i kontakt med CO2-luft, utan luft med bara kvävgas. Dvs dom kunde få en sann förskjutning av karbonaterna utan att ändra på den totala summan av dessa. När du höjer o sänker pH med CO2 så ändrar du också den totala halten av karbonater, som i sig lika mkt kan vara förklaringen till dina iaktagelser. Dvs skälet till dina iaktaglser kan va att när du vädrar ut CO2 o höjer ditt ph på det sättet så minskar du också på den totala halten av oorganiskt kol, och detta är i sin tur orsaken till lägre fotosyntes och också tillväxt his korallen. Skall du visa på att det beror på ökad energiåtgång så måste du ju ha en konstant nivå av oorganiskt kol, o då kan man bara göra som dom gjort, lufta mot ren kvävgas o höja o sänka med syra o bas medel. Det talas också om spontan hydrolys av HCO3, dvs en inte energikrävande process alls för omvandling/nyttjande acv HCO3. Du ser också i studiens första del att för den stammen man isolerat fritt, som nyttjar HCO3 hellre än CO2 till o med som sagt (den zooxanthellen som man isolerats från en korall men testat sen utanför korallen), inte är begränsad av mängden HCO3, då dess tillväxt ej ökar när man höjer nivåerna över NSW. Det betyder att det verkar inte va särskilt svårt för zooxanthellen att nyttja den mängd HCO3 den behöver för full fotosyntes, då alltså fotosyntesen EJ ökade när man höjde HCO3 till onaturligt höga nivåer, utan ökad bara upp till nsw.nivåer. Hela studiens budskap andas för mig att det är naturligt o till o med att föredra för zoox att uyttja HCO3, och till o med så att den måste göra det(när den är i en korall), den klarar sig inte med bara CO2 (förutom grupp 3 som var odlade o aldrig varit i en korall). Det tolkar jag som att spåret med att det skulle vara så energikrävande att nyttja HCO3 är tveksamt. Däremot håller jag helt med dig nu att fotosyntesen fortgår minst lika bra, ja till o med bättre, när vi tvingar in zoox på att nyttja HCO3. Där var jag osäker innan men denna studie har svarat på min fråga. Och som sagt, skälet isåfall till din iakttagna tillväxthämning vid Ph över 8.1, kan vara att du minskar ju på den totala mängden kol (CO2+HCO3+CO3) när du andas ut CO2 för att höja pH. Du ändrar ju då på två saker samtidigt, både relationen HCO3/CO2 men också den absoluta mängden HCO3+CO2. Det är ju den absoluta halten av HCO3 och CO2 det handlar om, och inte relationen. Det är ju inte konstigt då att fotosyntesen minskar vid utvädring av CO2(och totalkol), o därmed kanske kalkbildningen. Nu är ju ditt experiment det som liknar ett akvarium, så jag kan hålla med dig om att en utvädring av CO2 skulle kunna hämma tillväxten, MEN inte via den mekanism du föreslår, utan alltså isåfall via det faktum att man vädrar ut en viss mängd kol o därmed minskar man på mängden totalkol (HCO3+CO2), vilket sänker fotosyntesen, o därmed koralltillväxt. Det är egentligen detta jag skrev om i min artikel också om CO2-reaktorn, att det är kontraproduktivt att vädra ut för mkt av reaktorns CO2. Man blir ju av med kol. Så, vi kanske närmar oss en samsyn, men tror orsaken till din tillväxthämnking är en annan, alltså snarare via vägen över minskad mängd HCO3+CO2. Det betyder att om vi genomför det experiment du föreslog så tror jag som du, att min tillväxt kommer minska, men som sagt, av andra skäl.
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
Hela artikeln https://www.researchgate.net/profile/Claire_Goiran/publication/223045327_Inorganic_carbon_uptake_for_photosynthesis_by_the_symbiotic_coraldinoflagellate_association_I_Photosynthetic_performances_of_symbionts_and_dependence_on_sea_water_bicarbonate/links/547baa0f0cf293e2da2d737a.pdf
-
HCO3 som kolkälla åt zooxantheller och dinoflagelater mm
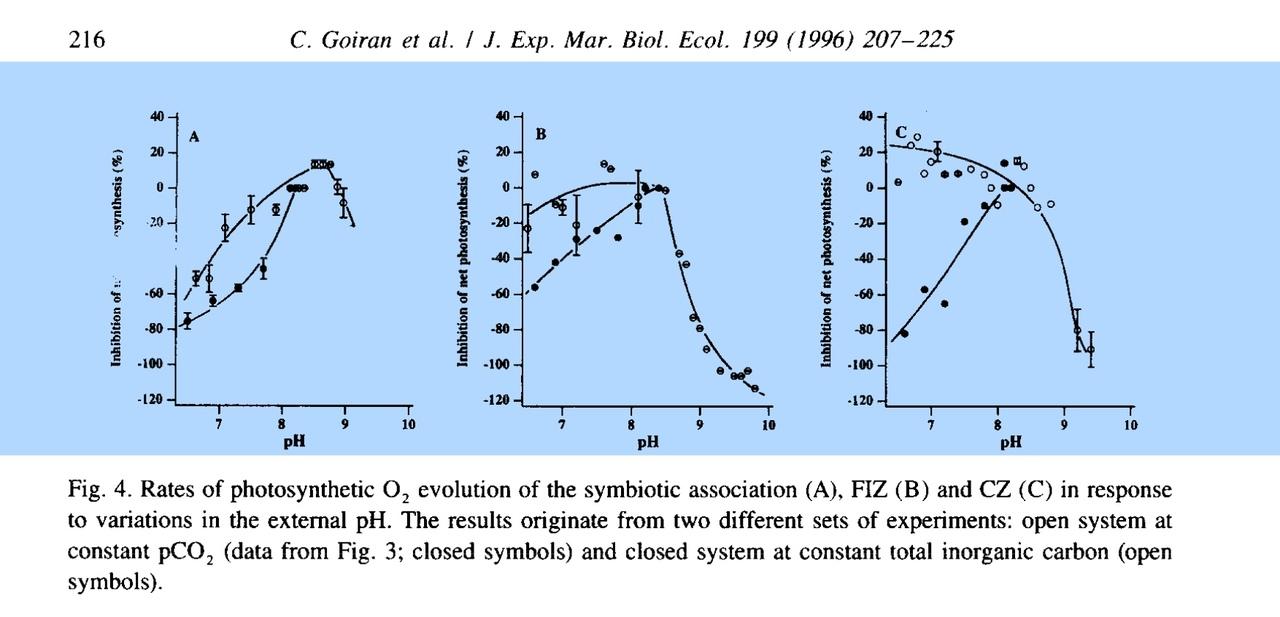
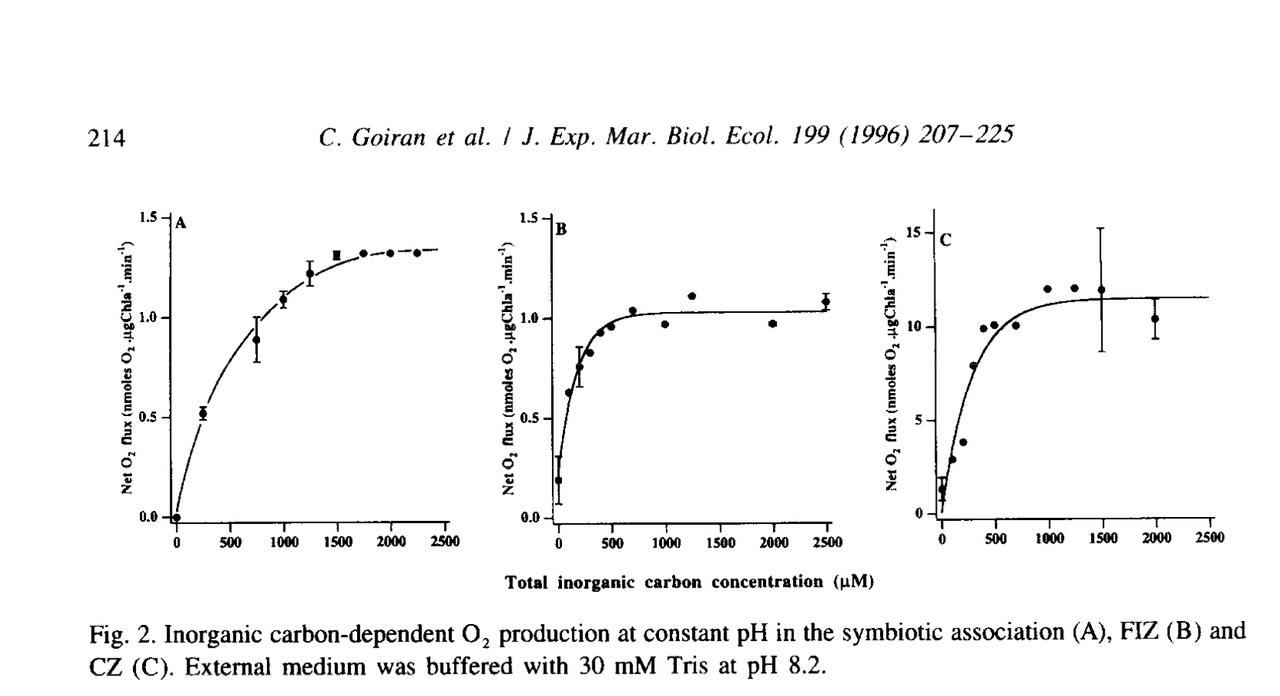
@Lasse, o jag har haft en fruktsam diskussion rörande hur en zooxanthells fotosyntes, och i förlängningen även koralls tillväxt, beror på olika pH samt KH-värden. Jag öppnar en ny separat tråd här i ämnet så vi inte behöver fortsätta i min akvarietråd. Den initiala huvudfrågan för mig är hur fotosyntesen för zooxantehellen ändras vid olika pH, och varför den isåfall ändras. Jag har nu lusläst denna mkt seriösa artikel, och sammanfattar den gärna för er. Denna, och lite annat kanske sen kommer ligga till grund för en artikel från mig där jag sammanfattar andra artiklar i ämnet(ej egna åsikter). Först o främst vill jag säga direkt, jag håller nu med Lasse, att zooxanthellens fotosyntes avtar inte om/när den tvingas nyttja HCO3 som kolkälla istället för CO2 (utan faktiskt till o med ökar, se nedan)! Ökningen av fotosyntesen fortsätter ända till pH 8.5 enligt studien. Vidare vet vi att det finns en stark koppling mellan fotosyntesen hos zooxantellen och kalkbildning. Därför tror jag att det Lasse kallar för sweetspot, det pH över vilken korallens tillväxthastighet avtar, ligger närmare 8.5. OBS, tror, vet ej, men jag baserar denna tro på bla denna artikel. (hoppa till sammanfattning längst ner i blått, om ni inte hänger med) STUDIEN Man har studerat fotosyntesen hos zooxanthellen vid 1) olika KH värden 2) olika pH värden a)olika pH via ändring av total karbonathårdhet(HCO3+CO3) men samma CO2(aq) b)olika pH värden med samma totala halt av karbonater (CO2+HCO3+CO3) men olika relationer mellan dessa. Dessutom har man tittat på tre olika zooxantheller A) de som sitter kvar inne i korallen isolerat "loss" från korallen o mätt på dom i det fria C) helt nya odlade zooxantheller som aldrig varit i en korall Och här kommer resultaten: 1) Fotosyntesen stiger med ökad karbonathårdhet för alla tre stammar. Särskilt intressant är dock att för stammarna B o C mättas kurvan av snabbt vid värden över naturliga värden (KH7),,medans för stam A (alltså för zooxanthellen i en korall), kan man gå mkt högre i KH innan man ser att fotosyntesökningen avtar. Slutsatsen här är att zooxanthellen och den fria dinoflagelaten nyttjar mkt effektivt HCO3 till sin fotosyntes. 2) Vid ökat pH via förändrad alkalinitet (alltså ej förändrad halt av CO2 i vattnet, vattnet står i total jämnvikt med luftens CO2 så CO2 är samma oavsett pH): samma resultat som i fallet 1, dvs: Med ökat pH stiger fotosyntesaktiviteten pgr av ökad halt av HCO3. 3) Vid ökat pH i vatten som EJ står i jämnvikt med luft: Här kommer det mest intressant försöket: Vi ändrar pH i vattnet med tillsats av en syra eller bas(NaOH eller HCL) o låter inte vattnet kunna vädra ut eller ta upp nån CO2 från luften. DVS: Halten av CO2+HCO3+CO3, dvs den totala mängden kol, är konstant. Vi förskjuter nu bara relationen mellan CO2/HCO3/CO3 genom att ändra pH via tillförsel av syra eller bas. Sedan mäter man fotosyntesaktiviteten igen för de tre olika stammarna. Resultat: Vid ökat pH STEG fotosyntesaktiviteten för stam 1 och 2, upp till pH cirka 8.5, sen sjunker den! Detta är det mest intressanta resultatet på hela studien tycker jag, för det visar att zooxanthellen inte bara kan använda HCO3, utan till o med föredrar det framför CO2!! Men, ni ser att detta gäller inte för den stammen som är helt odlad utanför korall(stam 3). Den följer mer det "förväntade" för alger, den föredrar CO2, dvs dess fotosyntes sjunker vid stigande pH. Sammanfattning: Zooxanthellen i en korall, men även utanför korallen (dinoflagelat fritt) utnyttjar i huvudsak HCO3 som kolkälla för sin fotosyntes. Vid ökad halt av HCO3 tex via ökad karbonathårdhet eller via ökat pH upp till ph 8.5 (då den relativa halten av HCO3 kontra CO2 ökar) stiger därför fotosyntesaktiviteten hos zooxanthellen i korallen. Vid ännu högre pH sjunker HCO3-halten till förmån för stigande CO3, som i sin tur ej kan nyttjas till fotosyntesen, varvid fotosyntesaktiviteten avtar vid pH över 8.5. Förrutom att zooxanthellen kan utnyttja HCO3, är det till o med så att den föredrar HCO3 framför CO2!, då man sett att vid en relativ förskjutning av HCO/CO2 åt CO2-hållet, så minskar fotosyntesen! Detta gäller dock enbart för zooxanthellen i korallen; För den helt fria dinoflagelaten råder den omvända situationen; även om den kan utnyttja HCO3 föredrar den CO2. /Jonas Roman PS:Postar lite understrykna saker, för att hjälpa er att hitta i texten. Jag tror inte alla kommer lusläsa artikeln som jag gjort. Artikeln postas också. DS
-
Mitt 650 liters sps
@Lasse Nu hittar jag inte artikeln men skall leta lite till. Vill förtydliga att jag har ingen stark uppfattning om vilka av dessa två orsaker till förekomst av sweetspot som är mest sann. Jag förstår teorin bakom båda, och det som talar för din är att man tex visat att faktiskt fotosyntesen stiger vid högre KH(dvs talandes för att carbanhydras finns i alla fall hos den korallen). Det är ju en av sambanden som ligger till grund får teorin om varför högt KH kan ge brända toppar: Högre alk=högre halt av HCO3=högre fotosyntes=mer bildande av fria radiakler, persoxider etc som skadar korallen. Det är ju också en förklaringsmodell till varför för mkt ljus(över en sweetspot där med) hämmar tillväxten, eller i alla fall inte ökar...mkt ljus, mer fotosyntes, mer bildande av radikaler, o korallen får lägga energi på att ta hand om detta o tillväxten sjunker. Det vore som sagt intressant om man kunde med den korall ni experimenterar på mäta inte bara tillväxt utan fotosynetsaktivitet i stunden vid olika pH-värden. Om den är samma eller i alla fall inte sjunker när du höjer pH till tex 8.4, ja då verkar ju denna korall ha sitt cabranhydras, och den isåfall påvisade minskade tillväxten beror på den du säger, ökad energiåtgång att fotosyntetisera vid detta pH. Om fotosyntesen däremot direkt avtar vid stigande pH (mätt som O2 produktion antar jag som mått på fotosyntesen?), så kan ju i just detta fall en minskad tillväxt bero på att korallens zooxanthell saknar, eller har inte tillräckligt med carbanhydrasaktivitet,dvs dess zooxanthell är mer CO2-beroende.